
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内气体压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
科目:高中化学 来源: 题型:
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2 vB =3 vA、3 vC = 2vB,则此反应可表示为
A.2A + 3B==2C B.A + 3B==2C
C.3A + B==2C D.A + B==C
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关pH变化的判断中,错误的是
A.随着温度的升高,醋酸溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石) ΔH= +11.9 kJ/mol,可知金刚石比石墨稳定
C.水力(水能)按不同的分类可看成可再生能源和一级能源
D.可表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是
A. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B. pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.25 ℃,将pH = 5的盐酸稀释1000倍后,溶液的pH=8
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图反应:X(g) + 3 Y(g)  2 Z(g)(正反应是放热反应),在不同温度不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线是
2 Z(g)(正反应是放热反应),在不同温度不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线是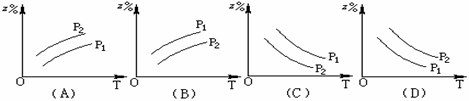
查看答案和解析>>
科目:高中化学 来源: 题型:
为了完成教材上的“中和热的测定”这个实验
(1)实验桌上有烧杯(大、小两个)、泡沫塑料、泡沫塑料板(中心有两个小孔)、环形玻璃搅拌棒,0.50mol·L-1盐酸、0.55mol·L—1NaOH溶液,尚缺少的实验用品是 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?答: (填“能”或“否”)。其原因是 。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g·cm—3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式: 。
(4)如果用50mL的0.60mol·L-1盐酸与50mL 的0.55mol·L—1NaOH溶液进行反应。若热量无损失,与上述实验相比,所求中和热 (填“偏大、偏小、相等”),简述理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子键、共价键的叙述中正确的是( )
A.离子化合物中只存在离子键,没有共价键
B.构成非金属单质分子的粒子中一定含有共价键
C.共价化合物分子中一定不存在离子键
D.仅由非金属元素组成的化合物中一定不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是短元素周期表的一部分,① ~⑨ 是元素周期表中的部分元素。
| ⅠA | 0 | |||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| …… | ② | ③ | ④ | |||||
| ⑤ | ⑥ | …… | ⑦ | ⑧ | ⑨ |
请回答下列问题:
(1)元素③④⑧的气态氢化物中最稳定的是 (填化学式)。
(2)元素⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是 。
(3)元素⑥和⑨形成的化合物的电子式是 。
(4)③、⑤、⑥形成的简单离子半径由大到小的顺序为 (写离子符号)
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式: 。
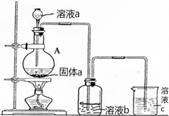 (6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
①浓溶液a和溶液b分别为 、 (写化学式)。
②浓溶液a与黑色固体a反应的离子方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com