
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。微粒物质的量的变化如图所示。下列说法正确的是
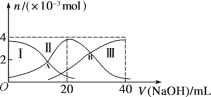
A. 当V(NaOH)=20 mL时,溶液中离子浓度关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B. 当V(NaOH)=30 mL时,则有:2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH减小
D. 若A、B两点对应的溶液pH值分别为a、b,则H2A![]() 2H++A2-的K=10-a-b
2H++A2-的K=10-a-b
【答案】D
【解析】
A.根据图象知,当V(NaOH)=20mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
B. 当V(NaOH)=30 mL时,溶质Na2A和NaHA且为1:1,根据电荷守恒和物料守恒判断;
C. NaHA以电离为主,溶液显酸性,加水稀释,酸性减弱;
D.根据A、B两点对应的溶液pH值分别为a、b,分别计算出H2A电离平衡常数K1和K2,然后在根据H2A![]() 2H++A2-计算K值。
2H++A2-计算K值。
A. 当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O;溶液主要为NaHA, HA-电离大于水解,溶液显酸性,结合水的电离平衡可知,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-), 故A错误;
B. 当V(NaOH)=30 mL时,溶液中溶质为Na2A和NaHA且为1:1;溶液中电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),物料守恒:2c(Na+)=3c(A2-)+3c(HA-)+3c(H2A),所以溶液中存在以下关系:2c(H+)+3c(H2A)+ c(HA-)=c(A2-) +2c(OH-),B错误;
C.二者恰好反应生成NaHA,加水稀释促进HA电离和水解,因为电离程度大于水解程度,溶液呈酸性,加水稀释导致氢离子个数增大,但氢离子物质的量的增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,溶液的pH增大,故C错误;
D. A点时,溶液中c(H2A )=c(HA-),H2A第一步电离的电离常数为K1= c(HA-)×c(H+)/ c(H2A )=10-a;B点时,溶液中c(A2- )=c(HA-),H2A第一步电离的电离常数为K2= c(A2- )×c(H+)/c(HA-)= 10-b ;H2A![]() 2H++A2-的K= c(A2- )×c2(H+)/c(H2A )= K2×K1=10-b×10-a=10-a-b,D正确;
2H++A2-的K= c(A2- )×c2(H+)/c(H2A )= K2×K1=10-b×10-a=10-a-b,D正确;
综上所述,本题选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】SiO2是____________的酸酐,不溶于水。常温下和NaOH溶液反应的化学方程式为________;碱性试剂不能保存在______塞的试剂瓶中。高温下,SiO2和碱性氧化物(如CaO)反应的化学方程式为:_______;常温下SiO2和氢氟酸反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
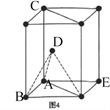
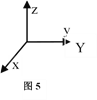
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M: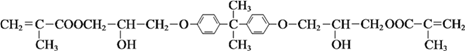 是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线:
是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线:
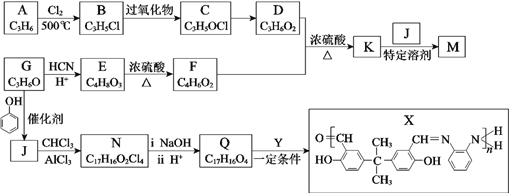
R、R1、R2代表烃基或其他基团,C属于环氧类物质。
![]()
![]()
![]()
(1)A为烯烃,B中所含官能团名称是_________,A→B的反应类型是_________。
(2)C→D的反应条件是____________。
(3)E分子中有2个甲基和1个羧基, F的化学名称是__________________。
(4)D+F→K的化学方程式是___________________________________。
(5)下列关于J的说法正确的是______。
a.可与Na2CO3溶液反应
b.1 mol J与饱和溴水反应消耗8 mol Br2
c.可发生氧化、消去和缩聚反应
(6)G分子中只有1种氢原子,G→J的化学方程式是_____________________________。
(7)N的结构简式是______________。
(8)Q+Y→X的化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生为探究苯与溴发生反应的原理,用如图装置进行实验.
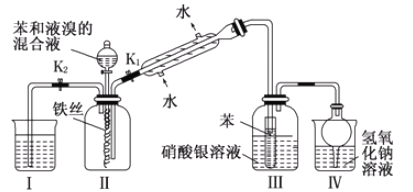
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,反应的化学方程式_____。过一会儿,在(Ⅱ)中瓶底观察到_____(Ⅲ)中可能观察到的现象是____
(2)整套实验装置中能防止倒吸的装置有_____(填装置序号)。
(3)反应结束后要使装置(I)中的水倒吸入装置(Ⅱ)中,这样操作的目的是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A.CH3CH2OH和CH3OCH3互为同分异构体
B.干冰和冰为同一种物质
C.CH3CH3和CH3CH2CH3互为同系物
D.12C和14C互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮的氧化物和灼热的铁按4NxOy+3yFe=yFe3O4+2xN2的反应式进行反应。在一个特定的实验中,2mol该氧化物与足量红热的铁完全反应,生成1molN2和1molFe3O4。该氧化物的化学式为( )
A.NOB.NO2C.N2OD.N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
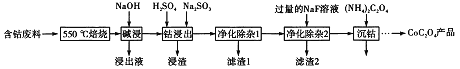
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃加入H2O2溶液,其目的是_____________。(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com