

| ||
| 5.6 |
| 56 |
| 3 |
| 2 |
| 23.3 |
| 233 |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、铜跟稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 分类标准 | 不属于该类别的物质 |
| 第①组 | ||
| 第②组 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
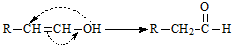 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com