
 已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19.常温下,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1H2A溶液的滴定曲线如图所示.下列说法正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19.常温下,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1H2A溶液的滴定曲线如图所示.下列说法正确的是( )| A. | a点所得溶液中:V0=10 mL | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) | |
| C. | c点所得溶液中:c(A2-)=c(HA-) | |
| D. | d点所得溶液中A2-水解平衡常数Khl=10-7.19 |
分析 A.a点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2A的一级电离平衡常数为Ka1=$\frac{c({H}^{+})c(H{A}^{-})}{c({H}_{2}A)}$10-1.85mol/L,据此分析;
B.b点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,根据溶液中质子守恒分析;
C.H2A的二级电离平衡常数为Ka2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=10-7.19mol/L,c点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,据此分析;
D.d点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,Na2A水解使溶液显碱性,结合图象分析.
解答 解:A.a点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2A的一级电离平衡常数为Ka1=$\frac{c({H}^{+})c(H{A}^{-})}{c({H}_{2}A)}$=10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHA)=c(H2A),若恰好是10mLNaOH,反应起始时存在c(NaHA)=c(H2A),平衡时c(H2A)<c(NaHA),因此所加NaOH体积需<10mL,会得到平衡时c(NaHA)=c(H2A),即V0<10mL,故A错误;
B.b点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,溶液中存在质子守恒,c(H2A)+c(H+)=c(A2-)+c(OH-),故B错误;
C.H2A的二级电离平衡常数为Ka2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=10-7.19mol/L,c点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=Ka2,表明溶液中c(A2-)=c(HA-),故C正确;
D.d点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,此时Na2A水解使溶液显碱性,溶液的pH为9.85,发生水解的方程式为A2-+H2O?HA-+OH-,则A2-水解平衡常数Khl=$\frac{c(H{A}^{-})c(O{H}^{-})}{c({A}^{2-})}$=$\frac{{K}_{w}}{{K}_{a2}}$=$\frac{1{0}^{-14}}{1{0}^{-7.19}}$=10-6.81,故D错误.
故选C.
点评 本题考查弱电解质的电离平衡,滴定原理,根据平衡常数和图象分析,牢牢把握守恒思想是解题的关键,题目难度中等.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应、中和反应及氧化反应 | |
| D. | 食用植物油在烧碱溶液水解属于皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的名称应为2-甲基-2-丙醇 的名称应为2-甲基-2-丙醇 | |
| B. | 2-甲基-3,6-己二醇根据羟基数目分类应属于二元醇 | |
| C. |  的名称为4-甲基-3,4-己二醇 的名称为4-甲基-3,4-己二醇 | |
| D. | 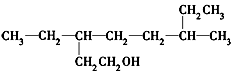 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ②①③⑤④ | C. | ③①②⑤④ | D. | ②③①⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取一定量的铁粉与2mol•L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)
取一定量的铁粉与2mol•L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
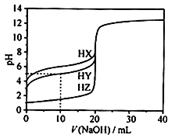 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )| A. | HZ是强酸,HX、HY是弱酸 | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)=c(Z-)+c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿酸 | B. | 蛋白质 | C. | 葡萄糖 | D. | 氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 做衣服的棉和麻灼烧有烧焦羽毛的气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com