
分析 由Ksp可知,Fe(OH)3的Ksp最小,则先加绿矾与含Cr2O72-废水发生氧化还原反应,然后调节pH使离子转化为沉淀,并结合Ksp计算pH.
解答 解:①FeSO4具有还原性,可与Cr2O72-+发生氧化还原反应生成Fe3+和Cr3+,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②由Ksp[Fe(OH)2]=1×10-15,Fe2+开始沉淀时,c(Fe2+)=0.1mol/L,溶液的pH=7.0;完全沉淀时,c(Fe2+)=1×10-5mol/L时,溶液的pH=9.0,Ksp[Cr(OH)3]=1×10-23,c( Cr3+)=10.0mol/L时,c(OH-)=1×10-8mol/L,pH=6.0,完全沉淀时,c(Cr3+)=1×10-5mol/L时,溶液的pH=8.0,
共沉淀的pH范围是7.0~8.0,
故答案为:7.0~8.0.
点评 本题考查难溶电解质的计算,为高频考点,把握氧化还原反应、Ksp的计算为解答的关键,侧重分析与应用能力的考查,注意共沉淀时pH为解答的难点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2的质量只有在标准状况下才约为2 g | |
| B. | 在标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol | |
| C. | 在20℃时,1 mol任何气体的体积总比22.4 L大 | |
| D. | 1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
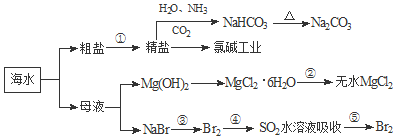
| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | 工业生产上向母液中加石灰乳使Mg2+转化为Mg(OH)2沉淀 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼时粗铜接电源负极 | |
| B. | 精炼时纯铜作阴极 | |
| C. | 杂质都将以单质形式沉积到池底 | |
| D. | 纯铜片增重2.56 g,电路中通过电子为0.04 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com