
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
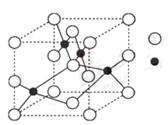
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
(4)铜元素和W元素都位于周期表的ds区,胆矾
CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
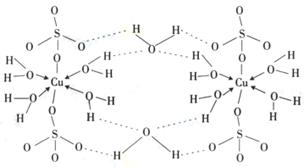
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
【知识点】分子结构、晶胞计算、化学键配合物
【答案解析】(1) SiH4 正四面体 (各1分)
(2)分子 CO2 (各1分)
(3) 4 (2分)
(4) AD (2分)
(5) NF3分子中氟原子非金属性强是吸电子的,使得氮原子上的孤对电子难于与Cu2+形成配位键。(2分)
解析:Y原子的L层p轨道中有2个电子,所以其核外电子排布式为1s22s22p2,为6号元素碳;Z与Y原子的价电子数相同,最外层为四个电子且均位于元素周期表的前四周期,为14号元素硅;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,所以其核外电子排布式为1s22s22p63s23p63d104s2,为30号锌元素;电荷数之和为51,51-30-6-14=1,则X的原子序数是1,是元素氢。
(1)Si与H形成只含一个中心原子的共价化合物SiH4,硅烷分子中含有4个σ键不含孤电子对,所以都是采取sp3杂化,立体构型是正四面体构型;(2)Y元素最高价氧化物为二氧化碳,晶体类型为分子晶体;X的氧化物是水,水是极性分子,二氧化碳是非极性分子,所以分子极性较小的是CO2;(3)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:8×1/8 +4×1/4 +2×1/2 +1=4;(4)A.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故A正确;B.在上述结构示意图中,存在极性共价键,不存在金属键,故B错误;C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确;(5)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子的孤对电子难以形成配位键,故NF3不易与Cu2+形成配离子。
【思路点拨】本题以元素的推断为载体考查了核外电子排布式的书写、分子中原子杂化方式的判断等知识点,离子晶体的晶胞结构、化学键、物质性质、配合物成键状况的了解,题目难度中等,学习中注意加强对晶胞以及晶体结构的分析。


科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别含有甲、乙两种常见金属元素的两种正盐A和B的混合物溶于水,通入氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色。若在该混合物的溶液中滴加一定浓度的氨水至过量,可得到白色沉淀C。向沉淀C加入过量NaOH溶液,沉淀部分溶解,剩余白色沉淀D。将D溶于盐酸,可得到A溶液;将D灼烧可得到优质的耐高温材料。
(1)试写出A和B的化学式:A ,B 。
(2)元素乙的单质可与某黑色固体反应置换出熔融态的铁,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施不合理的是 ( )
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素离子aA2+、bB+、cC3-、dD-都具有相
同电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>CB.原子序数d>c>b>a
C.离子半径C>D>B>AD.单质还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于Ⅲ区域的是( )
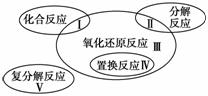
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3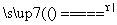 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com