
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol-1
② H2O(l) H2O(g) △H= + 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
方法一 | CO(g) +2H2(g) |
方法二 | CO2(g) +3H2(g) |
工业上可用如下方法合成甲醇:
方法一 方法二
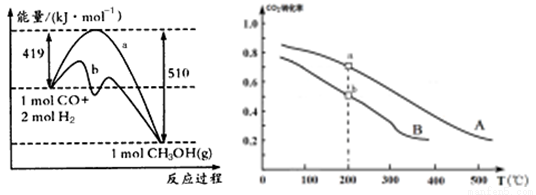
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的 倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
(1)CH3OH(l)十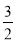 O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol
O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol
(2)①< 加入催化剂、AC; ② 大于 1.56
大于 1.56
(3) 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】
试题分析:(1)甲醇的燃烧热是1mold的甲醇完全燃烧产生液态水和气态二氧化碳时所释放飞热量。根据题意可得燃烧热数值为1275.6 kJ/mol÷2+2×44.0 kJ.mol=725.8kJ/mol,所以燃烧热的化学方程式为CH3OH(l)十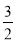 O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol;(2)①在方法一中由于消耗3mol的气体产生了1mol的气体,所以体系的混乱程度减小,因此该反应的△S<0;图中曲线a的活化能大,而曲线b的活化能小,所以曲线a到曲线b的措施是加入催化剂;A.因为反应前后气体的体积不等,若反应未达到平衡,则气体的物质的量就要发生变化,体系的平均摩尔质量也要改变,若体系的平均摩尔质量不变,则气体的物质的量不变,反应达到平衡。正确。B. 因为在方程式中CO与CH3OH的系数相同,所以任何时刻都存在V(CO)= V(CH3OH),因此该条件不能作为判断平衡的标志。错误。C. 若反应未达到平衡,则H2的转化率就没有达到了最大限度。现在H2的转化率达到了最大限度,说明反应达到了平衡状态。正确。D. 对于一个确定的反应,其△H不会因为反应进行的程度的大小而发生改变。因此该条件不能作为判断化学反应平衡状态的标志。错误。故选项为AC。②反应CO2(g) +3H2(g)
O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol;(2)①在方法一中由于消耗3mol的气体产生了1mol的气体,所以体系的混乱程度减小,因此该反应的△S<0;图中曲线a的活化能大,而曲线b的活化能小,所以曲线a到曲线b的措施是加入催化剂;A.因为反应前后气体的体积不等,若反应未达到平衡,则气体的物质的量就要发生变化,体系的平均摩尔质量也要改变,若体系的平均摩尔质量不变,则气体的物质的量不变,反应达到平衡。正确。B. 因为在方程式中CO与CH3OH的系数相同,所以任何时刻都存在V(CO)= V(CH3OH),因此该条件不能作为判断平衡的标志。错误。C. 若反应未达到平衡,则H2的转化率就没有达到了最大限度。现在H2的转化率达到了最大限度,说明反应达到了平衡状态。正确。D. 对于一个确定的反应,其△H不会因为反应进行的程度的大小而发生改变。因此该条件不能作为判断化学反应平衡状态的标志。错误。故选项为AC。②反应CO2(g) +3H2(g)  CH3OH(g) +H2O(g) 在a点时的平衡常数是
CH3OH(g) +H2O(g) 在a点时的平衡常数是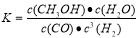 由于a,b两点对应的温度相同,CO2的转化率a>b,说明压强a>b,在其它条件不变时增大压强,物质的浓度增大,化学反应速率加快,所以Va>Vb表示;在方法一中由于反应物的原子全部转化为生成物,所以其原子利用率是100%;而方法二中原子利用率是32÷(32+18)×100%=64%.因此方法一的原子利用率是方法二的原子利用率的100% ÷64% =1.56。(3)根据题意可得Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
由于a,b两点对应的温度相同,CO2的转化率a>b,说明压强a>b,在其它条件不变时增大压强,物质的浓度增大,化学反应速率加快,所以Va>Vb表示;在方法一中由于反应物的原子全部转化为生成物,所以其原子利用率是100%;而方法二中原子利用率是32÷(32+18)×100%=64%.因此方法一的原子利用率是方法二的原子利用率的100% ÷64% =1.56。(3)根据题意可得Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查热化学方程式和离子方程式的书写、体系的混乱程度和化学平衡状态的判断、平衡常数的表达式的书写、原子利用率的计算的知识。


科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:填空题
(9分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
下列有机物名称正确的是
A.2-乙基戊烷 B.1,2-二氯丁烷
C.2,2-二甲基-4-己醇 D.3,4-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
某饱和一元醇和饱和一元醛的混合物共3g,跟足量银氨溶液完全反应(醛被氧化成羧酸)后,可还原出16.2g银,下列说法正确的是( )
A.一定是甲醛 B.可能是乙醛
C.混合物中醇和醛的质量比为1∶4 D.混合物不可能由甲醇和甲醛组成
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
下列化学用语正确的是
A.1,2—二溴乙烷的结构简式:C2H4Br2 B.羟基的化学式:OH-
C.己烷的分子式:C6H12 D.乙烯分子的最简式:CH2
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
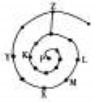
A.L、M、X三元素位于同一族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素对应的氢化物比K元素对应的氢化物沸点低
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(14分)工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是____________________。
(2)已知2SO2 (g)+ O2 (g) 2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L容积固定不变的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=____________。
②在①的条件下,判断该反应达到平衡状态的标志是_______(填字母)。
A.SO2 、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2 的生成速率和SO3的生成速率相等
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率 氧气的转化率(填大于、小于或等于)。
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁
B.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释
C.在c(H+)/c(OH-)= l012 溶液中 N a+、I-、NO3-、SO42-不能大量共存
D.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
要检验溴乙烷中的溴原子,正确的实验方法是
A.加入氯水振荡,观察水层是否有红棕色出现
B.滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,然后加入AgNO3溶液,观察有无浅黄色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com