
A.I1=I2 B.I1<I2 C.I1>I2 D.无法确定
科目:高中化学 来源: 题型:
 化学选做题----物质结构
化学选做题----物质结构查看答案和解析>>
科目:高中化学 来源: 题型:

| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三12月质量检测化学试卷(解析版) 题型:填空题
(12分)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物 。
(2)把Na2O、 SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列 。
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(4)Se原子基态核外电子的排布式为 ;H2Se的沸点:-41.1℃,H2S的沸点:-60.4℃引起两者沸点差异的主要原因是 ;
(5)SO32-离子中硫原子的杂化方式 ,该离子的立体构型为 ;
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,则该氧化物的化学式为 。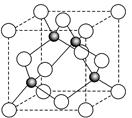
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com