
| A. | 标准状况下,2.24LNO与1.12L O2混合后的分子数小于0.1NA | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
分析 A、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
B、一水合氨为弱电解质,不能完全电离;
C、硫酸氢钾在熔融状态下只能电离为钾离子和硫酸氢根离子;
D、1mol铁和1mol氯气反应,铁过量,根据氯气反应后变为-1价来分析.
解答 解:A、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,故混合后分子个数小于0.1NA个,故A正确;
B、一水合氨为弱电解质,不能完全电离,故溶液中的氢氧根的个数小于0.1NA个,故B错误;
C、硫酸氢钾在熔融状态下只能电离为钾离子和硫酸氢根离子,故6.8g硫酸氢钾即0.05mol硫酸氢钾中含有的阳离子的物质的量为0.05mol,个数为0.05NA个,故C错误;
D、1mol铁和1mol氯气反应,铁过量,而氯气反应后变为-1价,故1mol氯气转移2NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题
| 物质名称 | 红磷与白磷 | 庚烷与十六烷 | 氯仿与三氯甲烷 | 氕与氘、氚 | 新戊烷与2,2-二甲基丁烷 | 2-甲基戊烷与2,3-二甲基丁烷 |
| 相互关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
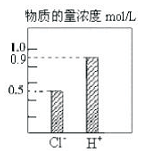 l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
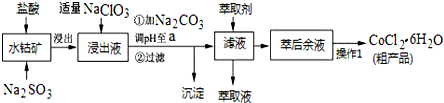
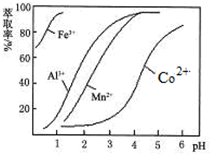
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
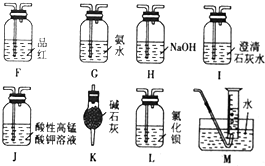
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
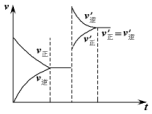 如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )| A. | 增加CO浓度 | B. | 升高温度 | C. | 增加水蒸气 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
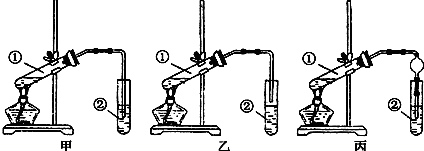
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com