
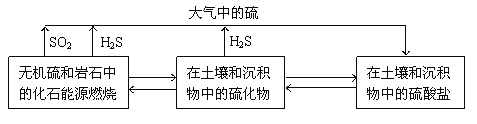
【题目】硫化物在自然界中的部分循环关系如图。
(1)H2S在空气中可以燃烧。
已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.38kJ/mol
S(s)+O2(g)=SO2(g) ΔH=-297.04kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是____。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会____(填“升高”、“不变”或“降低”)。
②为调整海水的pH,可加入新鲜的海水,使其中的HCO3-参与反应,其反应的离子方程式是____。
③在上述反应的同时需要大量鼓入空气,其原因是____。
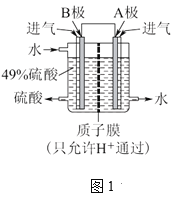
(3)某科研单位利用工业废气中的SO2来制取H2SO4。
①利用原电池原理,用SO2和O2来制备硫酸,装置如图1所示。B极的电极反应式是____。
②SO2经图2中的两个循环可分别得到S和H2SO4。下列说法正确的是____。
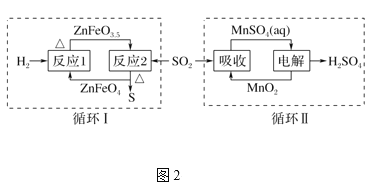
a.循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
b.循环Ⅰ中,反应2的化学方程式为SO2+4ZnFeO3.5![]() S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
d.循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
【答案】2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH=-1036.46kJ/mol 降低 HCO3-+H+=CO2↑+H2O 提高海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3![]() HSO3-+H+、HSO3-
HSO3-+H+、HSO3- ![]() SO32-+H+正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用 SO2-2e-+2H2O=SO42-+4H+ b、d
SO32-+H+正向移动,提高二氧化硫的转化率,同时起到加快反应速率的作用 SO2-2e-+2H2O=SO42-+4H+ b、d
【解析】
此题以硫的循环和相关化合物的转化为背景,考查了利用盖斯定律计算反应焓变的方法,以及热化学方程式的书写;同时也从反应原理的角度,考察了速率与平衡以及电化学的内容。
(1)H2S(g)与O2(g)反应生成SO2(g)和H2O(g)的热化学方程式为:![]()
![]() ;由盖斯定律可知该反应的
;由盖斯定律可知该反应的![]() ;
;
(2)①SO2溶于水生成亚硫酸,亚硫酸被氧气氧化后转变为硫酸,溶液的酸性增强,pH值下降;
②由于海水中生成了硫酸,属于强电解质,所以加入新鲜的海水后发生的离子方程式为:![]() ;
;
③通过鼓入大量空气,可以提高海水中溶解氧的含量,加速亚硫酸向硫酸的转化的同时,也提高了二氧化硫的转化率;
(3)①通过分析装置示意图,A极产物为水,说明这一极通入的为O2,那么B极的电极反应即为:![]() ;
;
②通过分析循环Ⅰ,SO2经过反应2后即被还原为S单质,那么反应1即为ZnFeO4还原再生ZnFeO3.5的过程;通过分析循环Ⅱ,SO2先被MnO2吸收转变为MnSO4,这个过程Mn降价而S升价,接着再电解MnSO4溶液分离得到硫酸产品的同时,再生了MnO2;
a.通过分析可知,ZnFeO3.5是反应1的还原产物,a错误;
b.通过分析可知,经过反应2后,SO2被还原为S单质,ZnFeO4被氧化为ZnFeO3.5,方程式正确,b正确;
c.通过分析可知,电解过程Mn从+2价被氧化为+4价,实现再生,因此,阳极材料不能使用Mn单质,c错误;
d.根据硫元素守恒可知,消耗同等质量的SO2,生成S和H2SO4的质量比为16:49,d正确;
答案选bd。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】(10分)碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。
(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是______(写出元素符号)。
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为________;常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是___________________。

(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是____________。
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个。实际上一个C60晶胞中含有________个C60分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.炭粉上发生的反应为:O2+4e-+4H+=2H2O
D.吸收氧气的过程中,铁作原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是( )
A | B | C | D | |
实验方案 |
置于光亮处 |
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
|
实验目的 | 验证甲烷与氯气发生化学反应 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证铁钉发生析氢腐蚀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加稀盐酸,直至溶液中n(Na+) = n(Cl-)。
下列说法正确的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①与③所得溶液相比,等体积时所含CH3COOH分子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子的检验说法正确的是
A.向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有![]()
B.向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有![]()
C.向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的红色石蕊试纸靠近试管口,若试纸不变蓝,则说明该溶液中无![]()
D.如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为高中化学教材《必修1》(人教版)中NaCl在水中的溶解和电离示意图。下列由此得出的说法中,错误的是
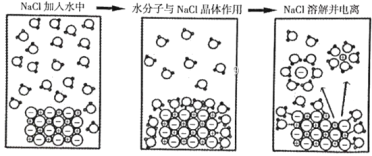
A.在H2O分子中,H或O原子均完全不带电荷
B.在NaCl晶体中,Na+和Cl-的排列整齐有序
C.Na+、Cl![]() 在水中是以水合离子的形式存在
在水中是以水合离子的形式存在
D.NaCl晶体的溶解和电离过程破坏了离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3遇水能迅速发生反应)。下列说法正确的是
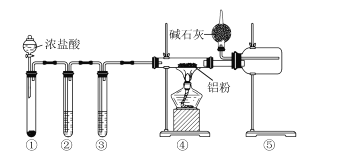
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.点燃④处酒精灯之前需排尽装置中的空气
D.球形干燥管中碱石灰的作用只有处理尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种用于合成胃酸分泌调节剂的药物中间体,其合成路线流程图如图:
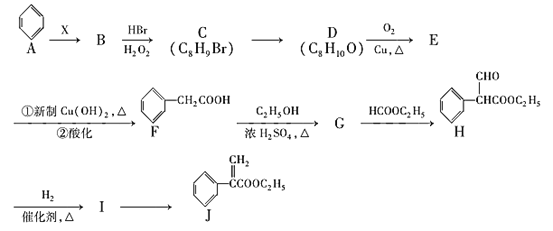
已知B为烃,其中含碳元素的质量分数为92.31%,其相对分子质量小于110。回答下列问题:
(1)H的官能团名称是__。
(2)X的名称为__。
(3)I→J的反应条件为__;A→B的反应类型为__。
(4)B分子中最多有__个碳原子在一条直线上。
(5)化合物I的多种同分异构体中,同时满足下列条件的同分异构体有__种。
①能发生水解反应和银镜反应②能与FeCl3溶液发生显色反应③苯环上有四个取代基,且苯环上一卤代物只有一种。其中,核磁共振氢谱有5组吸收峰物质的结构简式为__(任写一种即可)。
(6)参照上述合成路线,写出由F、甲醇、甲酸甲酯为有机原料制备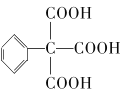 的合成路线流程图___(无机试剂任选)。
的合成路线流程图___(无机试剂任选)。
(7)酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
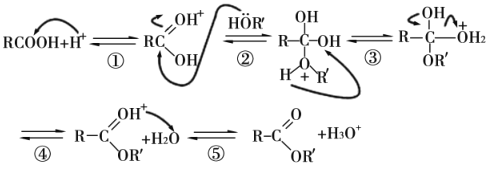
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯(![]() )的反应历程:
)的反应历程:
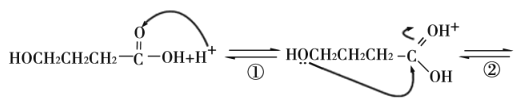 __。
__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com