
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
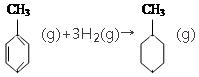 的焓变
的焓变| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
分析 ①燃烧热是1 mol可燃物完全燃烧生成稳定氧化物放出的热量,气态水不是氢元素的稳定氧化物;
②物质具有的能量越低,该物质越稳定;
③焓变只跟始态和终态有关,与加入X的量无关;
④苯环中的碳碳键是介于单键和双键之间特殊的键,题目中没有说明键能是多少;
⑤金刚石和石墨的结构不同,所具有的能量不同;
⑥燃烧热是1 mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1中生成的H2O应是液态,故①错误;
②A→B是吸热过程,说明A具有的能量比B低,能量越低越稳定,则A比B稳定,故②错误;
③△H只跟始态和终态有关,代表1 mol X完全反应后产生的热效应,平衡后加入X后△H不变,故③错误;
④由于苯环中的碳碳键是介于单键和双键之间特殊的键,题目中没有说明键能是多少,无法计算反应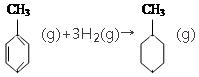 的焓变,故④错误;
的焓变,故④错误;
⑤金刚石和石墨的结构不同,所具有的能量不同,燃烧生成1 mol CO2气体时放出的热量是不同的,故⑤错误;
⑥25℃101kPa时,1mol碳完全燃烧生成CO2气体所放出的热量为碳的燃烧热,该说法合理,故⑥正确;
故选D.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确化学反应与能力变化的关系为解答关键,注意掌握反应热与焓变的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙显红色的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 溶有少量NaOH的溶液中:NH4+、Mg2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=1.0×10-12mol•L-1溶液中:K+、Na+、S2-、SO32- | |
| D. | 溶有大量FeCl3的溶液中:NH4+、Na+、CI-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后再充入少量X气体,上述反应的△H增大 | |
| B. | 达到平衡时,反应速率v正(X)=2v逆(Z) | |
| C. | 达到平衡后,降低温度,正向反应速率大于逆向反应速率 | |
| D. | 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:3:2 | B. | 6:2:3 | C. | 5:2:1 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | P2 | P3 | |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
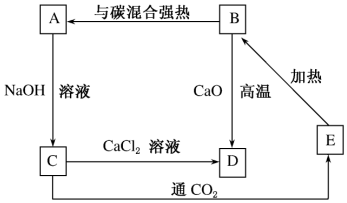
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl | B. | Ba(OH)2+H2SO4 | C. | Fe(OH)3+HNO3 | D. | KOH+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: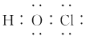 | |
| C. | 质子数为86、中子数为51的铯原子:86137Cs | |
| D. | S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的原子最外层有3个电子 |
| W | W的一种核素的质量数为28,中子数为14 |
| A. | W原子半径大于Z | |
| B. | 氢元素可以与X、Y分别形成的二元化合物分子间容易形成氢键 | |
| C. | 向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量无现象 | |
| D. | W的单质与氢氟酸反应生成两种无色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com