
【题目】下列指定反应的离子方程式正确的是( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO![]() +CaSO4=CaCO3+SO
+CaSO4=CaCO3+SO![]()
B.酸化NaIO3和NaI的溶液混合:I-+IO![]() +6H+=I2+3H2O
+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO![]() +3Cl-+4H++H2O
+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法不正确的是
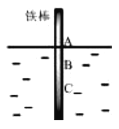
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-=4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.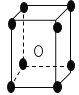 B.
B.
C.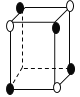 D.
D.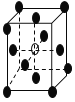
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:

(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com