
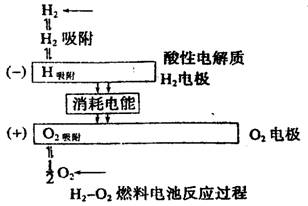
½«ĒāĘų(H2)”¢¼×Ķé(CH4)”¢ŅŅ“¼(C2H5OH)µČĪļÖŹŌŚĀČĘų(O2)ÖŠČ¼ÉÕŹ±µÄ»ÆѧÄÜÖ±½Ó×Ŗ»ÆĪŖµēÄܵÄ×°ÖĆ½ŠČ¼ĮĻµē³Ų”£Č¼ĮĻµē³ŲµÄ»ł±¾×é³ÉĪŖµē¼«”¢µē½āÖŹ”¢Č¼ĮĻŗĶŃõ»Æ¼Į”£“ĖÖÖµē³ŲÄÜĮæĄūÓĆĀŹæÉøß“ļ80£„(Ņ»°ć²ńÓĶ·¢µē»śÖ»ÓŠ40%×óÓŅ)£®²śĪļĪŪČ¾Ņ²ÉŁ”£ČĖĆĒŅŃ½«ĖüÓĆÓŚŗ½Ģģ·ÉŠŠĘ÷ÉĻ”£ĻĀĶ¼ĪŖĒāŃõČ¼ĮĻµē³Ų·“Ó¦µÄĶźÕū¹ż³Ģ”£¹ŲÓŚÉĻŹöĒāŃõČ¼ĮĻµē³ŲµÄĖµ·Ø²»ÕżČ·µÄŹĒ
A£®øŗ¼«·¢ÉśµÄ·“Ó¦£ŗH2£2e£===2H£«
B£®Õż¼«·¢ÉśµÄ·“Ó¦£ŗO2+2H2O+4e£===4OH£
C£®Č¼ĮĻµē³ŲÓŠŗÜøßµÄÖŹĮæ±ČÄÜĮæ(ÖŹÄܱČ)£®ĖłŅŌÓĆÓŚŗ½Ģģ·ÉŠŠĘ÷ÉĻ
D£®Č¼ĮĻµē³ŲµÄ²śĪļĪŖĖ®£¬¾¹ż“¦ĄķÖ®ŗóÕżŗĆæɹ©Óīŗ½Ō±Ź¹ÓĆ£¬øüæɼõÉŁŠÆ“ųÖŲĮæ

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

| Ź±¼ä/min | CH4£Ømol£© | H2O£Ømol£© | CO£Ømol£© | H2£Ømol£© |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
²éæ““š°øŗĶ½āĪö>>
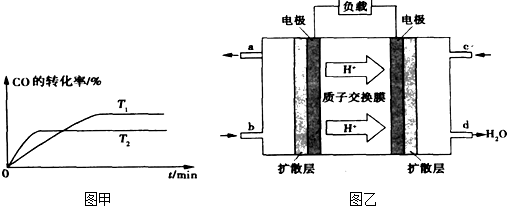
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| Ķصē |
| ¼ÓČČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğŗÓÄĻŹ”ÕņĘ½Ņ»øßø߶žµŚŅ»“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗµ„Ń”Ģā
½«ĒāĘų(H2)”¢¼×Ķé(CH4)”¢ŅŅ“¼(C2H5OH)µČĪļÖŹŌŚĀČĘų(O2)ÖŠČ¼ÉÕŹ±µÄ»ÆѧÄÜÖ±½Ó×Ŗ»ÆĪŖµēÄܵÄ×°ÖĆ½ŠČ¼ĮĻµē³Ų”£Č¼ĮĻµē³ŲµÄ»ł±¾×é³ÉĪŖµē¼«”¢µē½āÖŹ”¢Č¼ĮĻŗĶŃõ»Æ¼Į”£“ĖÖÖµē³ŲÄÜĮæĄūÓĆĀŹæÉøß“ļ80£„(Ņ»°ć²ńÓĶ·¢µē»śÖ»ÓŠ40%×óÓŅ)£®²śĪļĪŪČ¾Ņ²ÉŁ”£ČĖĆĒŅŃ½«ĖüÓĆÓŚŗ½Ģģ·ÉŠŠĘ÷ÉĻ”£ĻĀĶ¼ĪŖĒāŃõČ¼ĮĻµē³Ų·“Ó¦µÄĶźÕū¹ż³Ģ”£¹ŲÓŚÉĻŹöĒāŃõČ¼ĮĻµē³ŲµÄĖµ·Ø²»ÕżČ·µÄŹĒ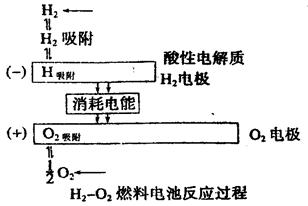
| A£®øŗ¼«·¢ÉśµÄ·“Ó¦£ŗH2£2e£===2H£« |
| B£®Õż¼«·¢ÉśµÄ·“Ó¦£ŗO2+2H2O+4e£===4OH£ |
| C£®Č¼ĮĻµē³ŲÓŠŗÜøßµÄÖŹĮæ±ČÄÜĮæ(ÖŹÄܱČ)£®ĖłŅŌÓĆÓŚŗ½Ģģ·ÉŠŠĘ÷ÉĻ |
| D£®Č¼ĮĻµē³ŲµÄ²śĪļĪŖĖ®£¬¾¹ż“¦ĄķÖ®ŗóÕżŗĆæɹ©Óīŗ½Ō±Ź¹ÓĆ£¬øüæɼõÉŁŠÆ“ųÖŲĮæ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com