
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.分析 (1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)和电源的负极相连的电极是阴极,该电极上发生得电子的还原反应;
(4)NaClO氧化NH3得到肼,次氯酸根离子被还原为氯离子.
解答 解:(1))32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;
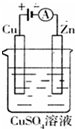
(3)金属锌和电源的负极相连,是阴极,该电极上发生得电子的还原反应Cu2++2e-=Cu;故答案为:Cu2++2e-=Cu;
(4)NaClO氧化NH3,制得肼的稀溶液,该反应的离子方程式是ClO-+2NH3=N2H4+Cl-+H2O,故答案为:ClO-+2NH3=N2H4+Cl-+H2O.
点评 本题考查了热化学方程式的书写、氧化还原反应、原电池和电解池原理,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al4C3晶体,熔点2200℃,熔融态不导电 | |
| B. | C3N4晶体具有比金刚石还大的硬度 | |
| C. | VF5晶体易溶于一些有机溶剂中 | |
| D. | BaCl2熔融状态下能够导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,最简单烯烃的结构简式为
,最简单烯烃的结构简式为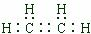 ,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为
,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为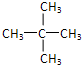 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$ $\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶 | |
| B. | 检验某卤代烃是否是氯代烃:试样$→_{煮沸}^{氢氧化钠溶液}$ 冷却 $\stackrel{稀硫酸至酸性}{→}$ $\stackrel{硝酸银溶液}{→}$出现白色沉淀 | |
| C. | 证明酸性条件H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$ $\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 除去氯化钠晶体中少量硝酸钾:试样$\stackrel{加适量水溶解}{→}$ $\stackrel{蒸发到剩少量液体}{→}$ $\stackrel{趁热过滤}{→}$ $\stackrel{洗涤晶体}{→}$再重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O | |
| B. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水 | |
| B. | 使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 实验室制氢气时加入CuSO4可加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com