
根据元素周期律判断,下列递变规律不正确的是 )。
A.Na、Mg、Al的金属性依次减弱
B.HCl、HBr、HI的稳定性依次增强
C.HClO4、H2SO4、H3PO4的酸性依次减弱
D.Li、Na、K与水反应的剧烈程度依次增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在一定温度、不同压强(p1<p2)下,可逆反应X(g)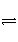
 Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图所示,正确的是( )
Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图所示,正确的是( )
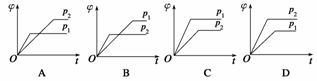
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A、若a=b,则c(NH )=c(Cl-) B、若a>b,则c(NH
)=c(Cl-) B、若a>b,则c(NH )>c(Cl-)
)>c(Cl-)
C、若a>b,则c(OH-)>c(H+) D、若a<b,则c(OH-)<c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
2Zns)+O2g)===2ZnOs) ΔH=-701.0 kJ·mol-1
2Hgl)+O2g)===2HgOs) ΔH=-181.6 kJ·mol-1
则反应Zns)+HgOs)===ZnOs)+Hgl)的ΔH为 )。
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是双选) )。
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q弱
D.X有多种同素异形体,而Y不存在同素异形体
| X | Y | ||
| Z | W | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
按右图所示的装置进行电解实验,A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极的质量增加7.68 g,溶液的质量增加0.03 g,则铜锌合金中Cu、Zn原子的个数比为
( )。

A.3∶1 B.4∶1 C.2∶1 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是
A.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
D.DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
A.该反应的正反应是吸热反应。
 B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
C.T1时,当反应处于D点,则该反应的逆反应速率
大于正反应速率。
D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的
曲线在原曲线上方。
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO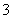 ,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
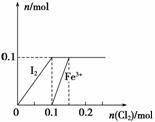
A.氧化性强弱:I2<Fe3+<IO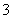
B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I-+6Cl2===5I2+2Fe3++12Cl-
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I-+3Cl2===2I2+2Fe3++6Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com