
”¾ĢāÄæ”æøßĢśµē³ŲŹĒŅ»ÖÖŠĀŠĶæɳäµēµē³Ų,ÓėĘÕĶصē³ŲĻą±Č,øƵē³ŲÄܽĻ³¤Ź±¼ä±£³ÖĪČ¶ØµÄ·ÅµēµēŃ¹”£øßĢśµē³ŲµÄ×Ü·“Ó¦ĪŖ3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH”£Ēė»Ų“šĻĀĮŠĪŹĢā:
3Zn(OH)2+2Fe(OH)3+4KOH”£Ēė»Ų“šĻĀĮŠĪŹĢā:
(1)øßĢśµē³ŲµÄøŗ¼«²ÄĮĻŹĒ____”£
(2)·ÅµēŹ±,Õż¼«·¢Éś____(Ģī”°Ńõ»Æ”±»ņ”°»¹Ō”±)·“Ó¦;ŅŃÖŖøŗ¼«·“Ó¦ĪŖZn-2e-+2OH-====Zn(OH)2,ŌņÕż¼«·“Ó¦ĪŖ_______________________”£
(3)·ÅµēŹ±,____(Ģī”°Õż”±»ņ”°øŗ”±)¼«ø½½üČÜŅŗµÄ¼īŠŌŌöĒ攣
”¾“š°ø”æ Zn»ņŠæ »¹Ō FeO42-+3e-+4H2OØTFe£ØOH£©3+5OH- Õż
”¾½āĪö”æ·ÖĪö£ŗŌµē³ŲÖŠøŗ¼«·¢ÉśŹ§Č„µē×ÓµÄŃõ»Æ·“Ó¦£¬Õż¼«·¢ÉśµĆµ½µē×ӵĻ¹Ō·“Ó¦£¬øł¾ŻøßĢśµē³ŲµÄ×Ü·“ӦŊ¶Ļ»¹Ō¼ĮŗĶŃõ»Æ¼Į£¬½įŗĻŌµē³ŲŌĄķ·ÖĪö½ā“š”£
Ļź½ā£ŗ£Ø1£©øł¾Ż×Ü·“Ó¦Ź½æÉÖŖŠæŹ§Č„µē×Ó£¬·¢ÉśŃõ»Æ·“Ó¦£¬ĖłŅŌøßĢśµē³ŲµÄøŗ¼«²ÄĮĻŹĒŠæ£»
£Ø2£©·ÅµēŹ±,Õż¼«·¢ÉśµĆµ½µē×ӵĻ¹Ō·“Ó¦”£ŅŃÖŖøŗ¼«·“Ó¦ĪŖ3Zn-6e-+6OH-£½3Zn(OH)2£¬ŌņĄūÓĆ×Ü·“Ó¦Ź½¼õČ„øŗ¼«·“Ó¦Ź½¼“æɵƵ½Õż¼«·“Ó¦ĪŖFeO42-+3e-+4H2O£½Fe£ØOH£©3+5OH-”£
£Ø3£©·ÅµēŹ±Õż¼«·“Ó¦ĪŖFeO42-+3e-+4H2O£½Fe£ØOH£©3+5OH-£¬·“Ó¦ÖŠ²śÉśĒāŃõøł£¬ĒāŃõøłÅضČŌö“ó£¬ĖłŅŌÕż¼«ø½½üČÜŅŗµÄ¼īŠŌŌöĒ攣


 ŠĒ¼¶æŚĖćĢģĢģĮ·ĻµĮŠ“š°ø
ŠĒ¼¶æŚĖćĢģĢģĮ·ĻµĮŠ“š°ø Ć¢¹ū½ĢøØ“ļ±ź²āŹŌ¾ķĻµĮŠ“š°ø
Ć¢¹ū½ĢøØ“ļ±ź²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃĒĻõĖįÄĘ(NaNO2)ŹĒÖŲŅŖµÄ·ĄøƼĮ”£Ä³ŹµŃ銔×éŅŌČēĶ¼ĖłŹ¾µÄ×°ÖĆŗĶŹŌ¼Į£¬Ķعż·“Ó¦ÖʱøŃĒĻõĖįÄĘ (²æ·Ö¼Š³Ö×°ÖĆĀŌ)”£
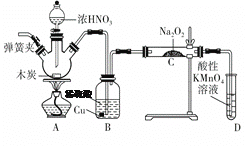
ŅŃÖŖ£ŗŹŅĪĀĻĀ£¬¢Ł2NO£«Na2O2===2NaNO2£»
¢ŚĖįŠŌĢõ¼žĻĀ£¬NO»ņNO2¶¼ÄÜÓėMnO4-·“Ӧɜ³ÉNO3-ŗĶMn2£«”£
Ķź³ÉĻĀĮŠĢīæÕ£ŗ
£Ø1£©Š“³öAÖŠČżÖÖÖ÷ŅŖ²£Į§ŅĒĘ÷µÄĆū³Ę __________ £¬___________£¬_________”£
£Ø2£©Š“³öÅØĻõĖįÓėľĢæ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_______________________”£
£Ø3£©BÖŠ¹Ū²ģµ½µÄÖ÷ŅŖĻÖĻóŹĒÓŠĪŽÉ«ĘųĢå²śÉśŗĶ______________£¬D×°ÖƵÄ×÷ÓĆŹĒ___________________________”£
£Ø4£©¾¼ģŃéC²śĪļÖŠ³żŃĒĻõĖįÄĘĶā»¹ŗ¬ÓŠø±²śĪļĢ¼ĖįÄĘŗĶĒāŃõ»ÆÄĘ£¬ĪŖ±ÜĆā²śÉśÕāŠ©ø±²śĪļ£¬Ó¦ŌŚB”¢C×°ÖĆ¼äŌö¼Ó×°ÖĆ£¬ŌņøĆ×°ÖĆÖŠŹ¢·ÅµÄŅ©Ę·Ćū³ĘŹĒ________”£
£Ø5£©ČōNO2æÉŅŌČ«²æ×Ŗ»Æ³ÉNO£¬½«1.56 g¹żŃõ»ÆÄĘĶźČ«×Ŗ»Æ³ÉĪŖŃĒĻõĖįÄĘ£¬ĄķĀŪÉĻÖĮÉŁŠčŅŖľĢæ________g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĻĀĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ£¬¹Ū²ģµ½µēĮ÷¼ĘÖøÕėĘ«×Ŗ£¬M°ō±ä“Ö£¬N°ō±äĻø£¬²¢²āµĆµē½āÖŹČÜŅŗµÄÖŹĮæ¼õŠ”£¬ÓÉ“ĖÅŠ¶ĻĻĀ±ķÖŠĖłĮŠM”¢N”¢PĪļÖŹ£¬ĘäÖŠæÉŅŌ³ÉĮ¢µÄŹĒ£Ø £©
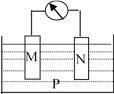
M | N | P | |
A | Zn | Cu | Ļ”ĮņĖįČÜŅŗ |
B | Cu | Fe | Ļ”ŃĪĖį |
C | Ag | Zn | ĻõĖįŅųČÜŅŗ |
D | Zn | Fe | ĮņĖįŃĒĢśČÜŅŗ |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬Ļņ10 mL 0.40 mol”¤L-1 H2O2ČÜŅŗÖŠ¼ÓČėŹŹĮæFeCl3ČÜŅŗ£¬²»Ķ¬Ź±æĢ²āµĆÉś³ÉO2µÄĢå»ż£ØŅŃÕŪĖćĪŖ±ź×¼×“æö£©ČēĻĀ±ķĖłŹ¾”£
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
׏ĮĻĻŌŹ¾£¬·“Ó¦·ÖĮ½²½½ųŠŠ£ŗ
¢Ł2Fe3++ H2O2 ![]() 2Fe2++O2”ü+2H+
2Fe2++O2ӟ+2H+
¢Ś H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

A. 0”«6 minµÄĘ½¾ł·“Ó¦ĖŁĀŹ£ŗv(H2O2) = 3.33”Į10-2 mol”¤L-1”¤min-1
B. Fe3+µÄ×÷ÓĆŹĒ¼Óæģ¹żŃõ»ÆĒāµÄ·Ö½āĖŁĀŹ
C. ·“Ó¦¢ŁŹĒĪüČČ·“Ó¦”¢·“Ó¦¢ŚŹĒ·ÅČČ·“Ó¦
D. ·“Ó¦2H2O2(aq)![]() 2H2O(l) + O2(g)µÄ”÷H =E1-E2 < 0
2H2O(l) + O2(g)µÄ”÷H =E1-E2 < 0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒ¦¼°Ęä»ÆŗĻĪļ¹ć·ŗÓĆÓŚŠīµē³Ų”¢»śŠµÖĘŌģ”¢µēĄĀ»¤·ĄµČŠŠŅµ”£
£Ø1£©Ē¦ŹĒĢ¼µÄĶ¬×åŌŖĖŲ£¬±ČĢ¼¶ą4øöµē×Ó²ć”£Ē¦ŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆĪŖ_________£»
£Ø2£©Ē¦Šīµē³ŲŹĒŅ»ÖÖÓĆĶ¾¹ć·ŗµÄ¶ž“Īµē³Ų”£Ē¦Šīµē³ŲµÄµē³Ų·“Ó¦Ķس£±ķŹ¾ČēĻĀ£ŗPb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O”£
2PbSO4 +2H2Oӣ
Ē¦Šīµē³Ų³äµēŹ±£¬¶žŃõ»ÆĒ¦µē¼«Ó¦ÓėĶā½ÓµēŌ“µÄ_________________£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©ĻąĮ¬½Ó£¬øƵē¼«µÄµē¼«·“Ó¦Ź½ĪŖ________________________________”£
£Ø3£©ĄūÓƵē½ā·ØæÉÖĘµĆ½šŹōĒ¦”£½«PbOČܽāŌŚHClŗĶNaClµÄ»ģŗĻČÜŅŗÖŠ£¬µĆµ½ŗ¬[PbC14]2-µÄµē½āŅŗ”£ÓƶčŠŌµē¼«µē½āNa2PbCl4ČÜŅŗÖĘµĆ½šŹōPb£¬×°ÖĆČēĻĀĶ¼ĖłŹ¾”£
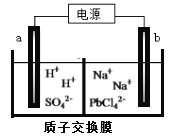
aµē¼«µÄĆū³ĘŹĒ__________£¬bµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ______________________
£Ø4£©PbO2æÉŅŌĶعżŹÆÄ«ĪŖµē¼«µē½āPb(NO3)2 ŗĶCu(NO3)2µÄ»ģŗĻČÜŅŗÖĘČ””£ŌņŃō¼«·¢Éś·“Ó¦µÄµē¼«·“Ó¦Ź½ĪŖ______________£¬Ņõ¼«ÉĻ¹Ū²ģµ½µÄĻÖĻóŹĒ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±±¾©Ź±¼ä11ŌĀ1ČÕĒå³æ5Ź±58·Ö07Ćė£¬ÖŠ¹ś”°³¤Õ÷¶žŗÅF”±Ņ£°ĖŌĖŌŲ»š¼żŌŚ¾ĘČŖĪĄŠĒ·¢ÉäÖŠŠÄŌŲČĖŗ½Ģģ·¢Éä³”µć»š·¢É䣬»š¼żµÄµŚČż¼¶Ź¹ÓƵÄĶĘ½ų¼ĮŹĒŅŗĒāŗĶŅŗŃõ”£
ŅŃÖŖĻĀĆęŌŚ298KŹ±µÄČČ»Æѧ·½³ĢŹ½£ŗ
2H2(g)+O2(g)== 2H2O(l) ¦¤H=-571.6 kJ”¤mol-1
CH4(g)+2O2(g)==CO2(g)+2H2O (l)¦¤H=-890.3 kJ”¤mol-1
C(s)+O2(g)== CO2(g)¦¤H=-393.5 kJ”¤mol-1
øł¾ŻÉĻĆęµÄČČ»Æѧ·½³ĢŹ½Ķź³ÉĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ķعż¼ĘĖćĖµĆ÷µČÖŹĮæµÄH2”¢C”¢CH4ĶźČ«Č¼ÉÕŹ±·Å³öČČĮæ×ī¶ąµÄŹĒ_________”£
£Ø2£©øł¾ŻŅŌÉĻ·“Ó¦£¬ŌņC(s)+2H2(g)== CH4(g)µÄģŹ±ä¦¤H=________________”£
£Ø3£©ŅŃÖŖH2O(l)== H2O(g) ¦¤H=+44.0 kJ”¤mol-1
ŹŌŠ“³ö¼×ĶéČ¼ÉÕÉś³É¶žŃõ»ÆĢ¼ŗĶĖ®ÕōĘųµÄČČ»Æѧ·½³ĢŹ½£ŗ________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČĖĆĒŌŚ°²»Õ·¢ĻÖĮĖČ«¹ś×ī“óµÄīāæó”£ÖÜĘŚ±ķÖŠīāŌŖĖŲµÄĻą¹ŲŠÅĻ¢ČēĶ¼ĖłŹ¾,ĻĀĮŠÓŠ¹ŲīāµÄĖµ·Ø“ķĪóµÄŹĒ
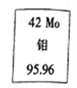
A. 95MoŌ×ÓŗĖÄŚÓŠ53øöÖŠ×Ó B. 95MoŌ×ÓŗĖĶāÓŠ42øöµē×Ó
C. 92Mo”¢95Mo”¢98MoĪŖĻąĶ¬ŗĖĖŲ D. 92Mo”¢95Mo”¢98MoµÄ»ÆѧŠŌÖŹĻąĖĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆÖŠŗĶµĪ¶Ø·Ø²ā¶ØÉÕ¼īµÄ“æ¶Č£ØÉÕ¼īÖŠµÄŌÓÖŹ²»ŗĶĖį·“Ó¦£©£¬Ēėøł¾ŻŹµŃé»Ų“š
£Ø1£©½«³ĘĮæŗƵÄ8.8gÉÕ¼īѳʷÅäÖĘ³É500mL“ż²āŅŗ£¬ÅäÖĘ¹ż³ĢŹ¹ÓƵÄÖ÷ŅŖŅĒĘ÷³ż500mLČŻĮæĘ攢ĮæĶ²”¢ÉÕ±”¢½ŗĶ·µĪ¹ÜĶā£¬»¹ÓŠŅ»ÖÖ±ŲŠėŹ¹ÓƵÄŅĒĘ÷ŹĒ £®
£Ø2£©ÓĆŹ½µĪ¶Ø¹ÜĮæČ”10.00mL“ż²āŅŗӌ׶ŠĪĘæÖŠ£¬µĪČė¼øµĪ·ÓĢŖ£®
£Ø3£©ÓĆ0.20molL©1µÄ±ź×¼ŃĪĖįµĪ¶Ø“ż²āŅŗ£¬ÅŠ¶ĻµĪ¶ØÖÕµćµÄĻÖĻóŹĒ£ŗ £®
£Ø4£©Čē¹ūŹµŃé²Ł×÷ÕżČ·£¬“ÓµĪ¶ØæŖŹ¼µ½½įŹų£¬ČÜŅŗÖŠµÄĄė×ÓÅØ¶Č¹ŲĻµæÉŅŌ³öĻֵďĒ£ØĢī“š°ø×ÖÄøŠņŗÅ£©
A.c£ØNa+£©£¾c£ØCl©£©£¾c£ØH+£©£¾c£ØOH©£©
B.c£ØNa+£©£¾c£ØOH©£©£¾c£ØCl©£©£¾c£ØH+£©
C.c£ØNa+£©+c£ØH+£©=c£ØOH©£©+c£ØCl©£©
D.c£ØCl©£©+c£ØNa+£©£¾c£ØOH©£©+c£ØH+£©
£Ø5£©øł¾ŻĻĀĮŠŹż¾Ż¼ĘĖć£¬c£ØNaOH£© mol/L
µĪ¶Ø“ĪŹż | “ż²āŅŗĢå»ż£ØmL£© | ±ź×¼ŃĪĖįĢå»ż£ØmL£© | |
µĪ¶ØĒ°¶ĮŹż£ØmL£© | µĪ¶Øŗó¶ĮŹż£ØmL£© | ||
µŚŅ»“Ī | 10.00 | 0.60 | 20.50 |
µŚ¶ž“Ī | 10.00 | 3.00 | 23.10 |
£Ø6£©¾¹ż·ÖĪö·¢ĻÖ£¬±¾“ĪŹµŃéµÄ²ā¶Ø½į¹ū±ČÉÕ¼īµÄŹµ¼Ź“æ¶ČĘ«øߣ¬Ōģ³ÉĪó²īµÄæÉÄÜŌŅņŹĒ
A.µĪ¶ØĒ°Ę½ŹÓ£¬µĪ¶Øŗóø©ŹÓ
B.Ī“ÓƱź×¼ŅŗČóĻ“µĪ¶Ø¹Ü
C.ÓĆ“ż²āŅŗČóĻ“׶ŠĪĘæ
D.²»Š”ŠÄ½«±ź×¼ŅŗµĪŌŚ×¶ŠĪĘæĶāĆę£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌŗ¬īÜ·Ļ“߻ƼĮ(Ö÷ŅŖ³É·ÖĪŖCo”¢Fe”¢SiO2)ĪŖŌĮĻ£¬ÖĘČ”Ńõ»ÆīܵÄĮ÷³ĢČēĻĀ”£
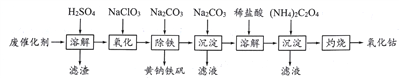
(1)Čܽā:Čܽāŗó¹żĀĖ£¬½«ĀĖŌüĻ“µÓ2~3“Ī£¬Ļ“ŅŗÓėĀĖŅŗŗĻ²¢£¬ĘäÄæµÄŹĒ__________________”£
(2)Ńõ»Æ:¼ÓČČ½Į°čĢõ¼žĻĀ¼ÓČėNaC1O3£¬Ęä×÷ÓĆŹĒ_______________________________”£
(3)³żĢś:¼ÓČėŹŹĮæµÄNa2CO3µ÷½ŚĖį¶Č£¬Éś³É»ĘÄĘĢś·ÆNa2[Fe6(SO4)4(OH)12]³Įµķ”£Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½:__________________________________________________”£
(4)³Įµķ:Éś³É³Įµķ¼īŹ½Ģ¼ĖįīÜ[(CoCO3)2”¤3Co(OH)2]£¬³ĮµķŠčĻ“µÓ£¬¼ģŃé³ĮµķŹĒ·ńĻ“µÓøɾ»µÄ²Ł×÷ŹĒ_________________________________________________________”£
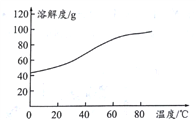
(5)Čܽā:CoCl2µÄČܽā¶ČĒśĻßČēĶ¼ĖłŹ¾”£Ļņ¼īŹ½Ģ¼ĖįīÜÖŠ¼ÓČė×ćĮæĻ”ŃĪĖį£¬±ß¼ÓČČ±ß½Į°čÖĮĶźČ«Čܽāŗ󣬊č³ĆČČ¹żĀĖ£¬ĘäŌŅņŹĒ__________________________________”£
(6)×ĘÉÕ:×¼Č·³ĘČ”ĖłµĆCoC2O4¹ĢĢå2.205g£¬ŌŚæÕĘųÖŠ×ĘÉÕµĆµ½īܵÄŅ»ÖÖŃõ»ÆĪļ1.205g£¬Š“³öøĆŃõ»ÆĪļµÄ»ÆѧŹ½_________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com