
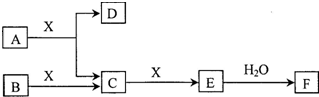
 �ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��D��E��F��Xת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
�ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��D��E��F��Xת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
| ||
| ||


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������β��-�⻯ѧ��Ⱦ-���Ժ����������� |
| B������ϴ�·�-ˮ�帻Ӫ����-ˮ�ܶ���������� |
| C��������-�����ն�-Ƥ����֢������ |
| D���˿�����-������CO2Ũ������-���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
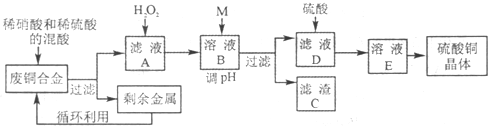
| Fe3+ | Fe2+ | Cu2+ | Al3+ | |
| ��ʼ����ʱpH | 2.2 | 7.5 | 5.2 | 3.7 |
| ��ȫ����ʱpH | 3.2 | 9.0 | 6.7 | 4.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��־���������
��־����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��64 | B��32 |
| C��64g/mol | D��32g/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com