
| A�� | Q1=Q2=Q3=57.3 | B�� | Q1��Q2��Q3��57.3 | C�� | Q3��Q1��Q2=57.3 | D�� | ��ȷ�� |
���� ϡ��ǿ����ǿ������1molH2O�ų�������Ϊ�к��ȣ�ע��������ʵĵ������������
��� �⣺ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��+OH-��aq��=H2O��H=һ57.3kJ/mol��
CH3COOH��aq��+NaOH��aq���TCH3COONa��aq��+H2O��l����H=-Q1 kJ•mol-1
HNO3��aq��+NaOH��aq���TNaNO3��aq��+H2O��l����H=-Q2 kJ•mol-1
CH3COOH��aq��+NH3•H2O��aq���TCH3COONH4��aq��+H2O��l����H=-Q3 kJ•mol-1
����ĵ������ȣ�NH3•H2O�������ȣ���ų�������Ϊ57.3=Q2��Q1��Q3��
��ѡC��
���� ���⿼���к��ȣ���ȷ�к��ȵĸ��������ʵĵ������ЧӦ���ɽ���ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O | B�� | BF3 | C�� | COCl2 | D�� | SF6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
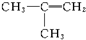 ����ͬ�ࣨ��ͬ�ࡱ��ͬ�ࡱ�����ʣ�����ʽΪC4H8����������̼���칹�壮
����ͬ�ࣨ��ͬ�ࡱ��ͬ�ࡱ�����ʣ�����ʽΪC4H8����������̼���칹�壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
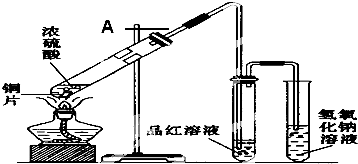
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
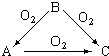 ������ij����ɫ���嵥��A����������̬�⻯��B��������C֮�䣬����ͼ��ת���ϵ����ش𣺣�1��A��S��B��H2S��C��SO2��
������ij����ɫ���嵥��A����������̬�⻯��B��������C֮�䣬����ͼ��ת���ϵ����ش𣺣�1��A��S��B��H2S��C��SO2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
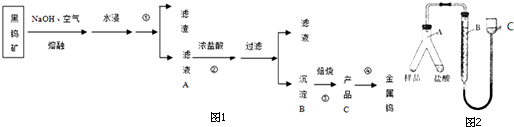
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
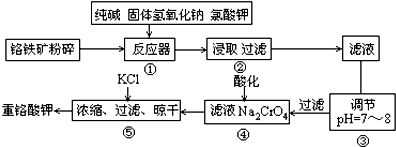
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڴ����ᴿ�У������ȵ����������н϶������������������Һ��ʱ��ֹͣ���ȣ������Ƚ�Һ������ | |
| B�� | ����Һ©���еĻ����Һʱ������һֻ��ѹס��Һ©���IJ���������һֻ����ס����������Һ©����ת������������ | |
| C�� | �Ӽӵ����л�ȡ�ⵥ�ʵIJ�������Ϊ���ܽ�-��ȡ-��Һ-���� | |
| D�� | ʵ���������Ƥ������մ��������Һ��Ӧ���ô���ˮ��ϴ������2%������Һ��������Һϴ�������ˮ��ϴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ڱ�����A��B��C����ԭ���������������Ԫ�أ�A�ǵؿ��к������Ľ���Ԫ�أ�B�ļ۲�����Ų�Ϊnsn-1npn+1��C�������е�һ�ֳ��ý�������ԭ�ӵ���Χ�����Ų�Ϊ3d104s1��
���ڱ�����A��B��C����ԭ���������������Ԫ�أ�A�ǵؿ��к������Ľ���Ԫ�أ�B�ļ۲�����Ų�Ϊnsn-1npn+1��C�������е�һ�ֳ��ý�������ԭ�ӵ���Χ�����Ų�Ϊ3d104s1���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com