

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率(×10-3mol.min-1 | 7.34 | 3.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |


科目:高中化学 来源: 题型:
| A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、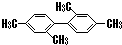 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol有机物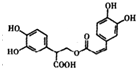 一定条件下能和7molNaOH反应. 一定条件下能和7molNaOH反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用饱和溴水除去苯中的苯酚 |
| B、丙烯加聚时可形成顺反两种聚合物 |
| C、常压下的沸点:1-丙醇>乙醇>丙烷 |
| D、蔗糖及其水解产物均能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化钙用作儿童食品的干燥剂存在安全隐患 |
| B、聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| C、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| D、绿色化学的核心是利用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当金属全部溶解时,失去电子的物质的量为0.3 mol |
| B、当金厲全部溶解时收集NO气体体积为2.24 L |
| C、当生成的沉淀量达最大时,消耗NaOH溶液的体积V≥100 mL |
| D、参加反应的金属总质量为9.6 g>m>3.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中流经外电路的电子数目为0.1NA |
| B、在标准状况下,两极共产生3.92L气体 |
| C、电解后溶液的pH为2(假设溶液体积不变) |
| D、加入13.8g Ag2CO3可将溶液彻底复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、T1和T2的关系是:T1>T2 |
| B、Kw的关系是:B>C>A=D=E |
| C、A点到D点:加入少量酸可实现 |
| D、T2时:pH=2的硫酸与pH=12的NaOH溶液等体枳混合,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA |
| C、0.l mol O3和O2的混合气体中含氧原子数目为0.2NA |
| D、0.1 mol NA完全被氧化生成Na2O2,转移电子的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com