
【题目】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__(填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____。1 mol HCHO分子中含有σ键的物质的量为____mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__。与H2O分子互为等电子体的阴离子为__。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________。
(2)元素B、C、D的第一电离能由小到大排列顺序为________。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________。
【答案】 d 3 ![]() 或
或![]() 1s22s22p63s23p63d10 3 sp3、sp NH2-
1s22s22p63s23p63d10 3 sp3、sp NH2- ![]() [Cu(NH3)4]SO4·H2O S<O<N
[Cu(NH3)4]SO4·H2O S<O<N ![]() H2O与H2O2之间形成氢键 6CuH+16HNO3===6Cu(NO3)2+3H2↑+4NO↑+8H2O
H2O与H2O2之间形成氢键 6CuH+16HNO3===6Cu(NO3)2+3H2↑+4NO↑+8H2O
【解析】I.(1)考查能级,a、N的最外层有5个电子,得到3个电子达到稳定结构,即N3-没有未成对电子;b、Fe价电子排布式是3d64s2,Fe3+价电子排布式为3d5,有5个未成对电子;c、Cu的价电子排布式为3d104s1,只有1个未成对电子;d、Cr的价电子排布式为3d54s1,有5个未成对电子;e、C价电子排布式为2s22p2,2个未成对电子;综上所述,未成对电子最多的是Cr,故d正确;(2)考查第一电离能的规律,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,符合信息的元素是Be、C、O有三种;(3)考查氢键,根据氢键的形成,八元环是![]() 或
或![]() ;(4)本题考查电子排布式、化学键类型、杂化类型、等电子体、配合物等知识,①Zn位于第四周期第IIB族,其核外电子排布式为[Ar]3d10;甲醛的结构式为
;(4)本题考查电子排布式、化学键类型、杂化类型、等电子体、配合物等知识,①Zn位于第四周期第IIB族,其核外电子排布式为[Ar]3d10;甲醛的结构式为![]() ,成键原子只能形成一个σ键,因此1mol甲醛中含有的σ键的物质的量为3mol;②有两种碳原子,以单键形成的碳原子,是sp3杂化类型,C和N之间形成叁键,此碳原子是sp杂化;等电子体是价电子总数相等,原子总数相同的微粒,因此与H2O互为等电子体的阴离子是NH2-;③根据信息,Zn2+提供空轨道,CN-中C提供孤电子对,应是
,成键原子只能形成一个σ键,因此1mol甲醛中含有的σ键的物质的量为3mol;②有两种碳原子,以单键形成的碳原子,是sp3杂化类型,C和N之间形成叁键,此碳原子是sp杂化;等电子体是价电子总数相等,原子总数相同的微粒,因此与H2O互为等电子体的阴离子是NH2-;③根据信息,Zn2+提供空轨道,CN-中C提供孤电子对,应是![]() ;II.C和D属于主族,且原子序数D为C的二倍,即D为S,C为O,根据E的外围电子排布式,推出E为Cu,根据问题(4)可以与氧形成1:1和1:2的化合物,且两种化合物任意比例互溶,因此推出A为H,B为N,(1)考查化学式的书写,根据原子个数比,推出化学式为[Cu(NH3)4]SO4·H2O ;(2)考查第一电离能的规律,非金属性越强第一电离能越大,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,第一电离能的大小顺序是N>O>H;(3)考查轨道式的书写,D为S,最外层有6个电子,电子排布式为3s23p4,轨道式为
;II.C和D属于主族,且原子序数D为C的二倍,即D为S,C为O,根据E的外围电子排布式,推出E为Cu,根据问题(4)可以与氧形成1:1和1:2的化合物,且两种化合物任意比例互溶,因此推出A为H,B为N,(1)考查化学式的书写,根据原子个数比,推出化学式为[Cu(NH3)4]SO4·H2O ;(2)考查第一电离能的规律,非金属性越强第一电离能越大,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,第一电离能的大小顺序是N>O>H;(3)考查轨道式的书写,D为S,最外层有6个电子,电子排布式为3s23p4,轨道式为![]() ;(4)考查影响溶解度的因素,形成的化合物是H2O和H2O2,H2O与H2O2之间形成分子间氢键,两者互溶;(5)考查化学方程式的书写,化合物是CuH,与硝酸反应生成蓝色溶液,即为Cu(NO3)2,两种气体为H2和NO,因此反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O。
;(4)考查影响溶解度的因素,形成的化合物是H2O和H2O2,H2O与H2O2之间形成分子间氢键,两者互溶;(5)考查化学方程式的书写,化合物是CuH,与硝酸反应生成蓝色溶液,即为Cu(NO3)2,两种气体为H2和NO,因此反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O。


科目:高中化学 来源: 题型:
【题目】已知铍的原子半径为0.089 nm,下面是几种短周期元素的相关信息(该题中大写字母均为元素代号,不是元素符号)
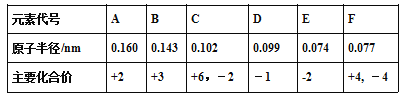
(1)C元素的简单阴离子结构示意图________,F元素在周期表中的位置____________。
(2)D的单质与水反应的离子方程式_____________,该反应生成的含氧酸的电子式________。
(3)F元素与半径最小的元素形成的最简单有机化合物的结构式___________。
(4)钠元素与E元素形成的所有化合物中,可能含有的化学键类型_______(填字母代号)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键
(5)B、C、E三种元素的简单离子半径由大到小顺序________________(填离子符号)。
(6)某同学选取稀硫酸、过量碳酸氢钠溶液和过量硅酸钠溶液,并设计了下图装置完成硫、碳、硅三种元素非金属性强弱比较的实验研究。下图中装置Ⅰ的名称_______,装置Ⅲ中反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠在染料工业有着重要的用途。工业中常用煤粉(主要成分为碳)还原芒硝(Na2SO4)制备硫化钠。
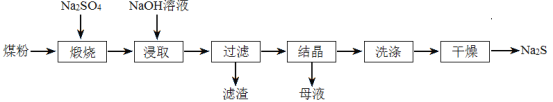
(1)①煅烧时煤粉把Na2SO4还原为Na2S,反应方程式为 。煤粉的作用是a.作为还原剂生成CO2、b. 。
②煅烧时常有副反应发生:Na2S+4CO2![]() Na2CO3+SO2+3CO
Na2CO3+SO2+3CO
4Na2S+O2![]() 2Na2S2+2Na2O
2Na2S2+2Na2O
为了控制杂质的生成可采取的措施是 。
(2)浸取用NaOH溶液而不用水的原因是 。
(3)滤渣需要用水洗涤回收,其目的是 。
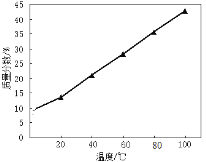
(4)随温度升高溶液中Na2S最高含量如图所示,工业上加热滤液到100 ℃以上但只蒸发到含Na2S 38%—39%,然后冷却结晶,其原因是 。
(5)干燥需要在真空中操作,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对十二烷基苯磺酸钠![]() 是常用洗涤剂的主要成分。
是常用洗涤剂的主要成分。
其结构可用图形![]() 来表示,端为链烃基,O端为极性基。根据这一结构特点,试分析和回答下列问题:
来表示,端为链烃基,O端为极性基。根据这一结构特点,试分析和回答下列问题:
(1)十二烷基苯磺酸钠分子在其水溶液表面分布的结构示意图应是下列各图中的____图(填写序号),理由是____________________________________。
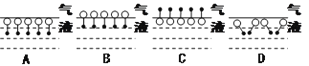
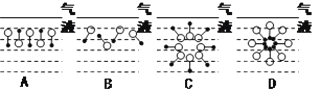
(2)进入介质(水)内部的十二烷基苯磺酸钠分子,可能会以下列结构形式中的____存在(填写序号),理由是____________________________________。
(3)工业合成对十二烷基苯磺酸钠的一种路线如下图所示:
![]()
![]()
请回答下列问题:
①产品中的亲油基是_______。
②由十二烷基苯制取对十二烷基苯磺酸的化学方程式为_________,反应类型为__________。
③在洗涤剂中添加酶制剂能促进污垢中的蛋白质(如奶渍、肉汤)等水解为可溶性的物质而被除去。使用加酶洗衣粉的水溶液中浸泡10~30min,水温在40~50℃最佳。加酶洗衣粉不宜在高温下、潮湿环境中贮存,也不宜久存。请解释原因_________________________________。
④过去使用的合成洗涤剂中常加入三聚磷酸钠(Na5P3O10)做助剂,它可使硬度大的洗涤水软化,对微细的无机粒子或油脂具有分散、乳化、胶溶作用,防止污渍再次沉积到衣物上;它还能维持水溶液的弱碱性,提高洗涤剂的去污能力和洗涤效果。但是,20世纪90年代以来,世界各国先后提出必须生产和使用无磷洗涤剂。请解释原因______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是

A.原子半径:W<X<Y
B.W与X组成的化合物中只有极性键
C.Y与Z组成的化合物一定有漂白性
D.非金属性:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
D是一种催眠药,F是一种香料,它们的合成路线如下:

(1)A的化学名称是______,C中含氧官能团的名称为______。
(2)F的结构简式为______,A和E生成F的反应类型为______。
(3)A生成B的化学方程式为_______________。
(4)B与乙炔钠合成C的反应类型(酸化前)是_________;写出由C合成D的第二个反应的化学方程式___________________________________。
(5)同时满足下列条件的E的同分异构体有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g) ![]() 2HI(g)的反应类型判断错误的是( )
2HI(g)的反应类型判断错误的是( )
A. 吸收能量的反应 B. 放出能量的反应
C. 氧化还原反应 D. 可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com