
����Ŀ���������(A)Ϊԭ�Ϻϳ�(��)-ˮ��ȩ(C10H16O)��·�����£�

(1)(��)-ˮ��ȩ�Ĺ���������Ϊ______��_______��
(2)G��H��Ӧ�ķ���ʽΪ_____________��
(3)H��I�ķ�Ӧ����Ϊ_____________��
(4)B��K�Ľṹ��ʽ�ֱ�Ϊ_____________��_____________��
(5)����J��(��)һˮ��ȩ��ѡ�õ��Լ�Ϊ___________��
a.NaHCO3��Һ b.��ˮ c.����KMnO4��Һ d.����Cu(OH)2
(6)��������������D��ͬ���칹����___�֣����к˴Ź�������Ϊ1:1:2:2:6�Ľṹ��ʽΪ____��
����������Ʒ�Ӧ����������
�ڲ���ʹFeCl3��Һ��ɫ��
�ۺ��б����ұ����ϲ���������ȡ������
(7)����������Ϣ����������·�ߣ���![]() Ϊԭ�ϣ�ѡ���Ҫ�Լ����
Ϊԭ�ϣ�ѡ���Ҫ�Լ����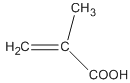 �ĺϳ�·��____________��
�ĺϳ�·��____________��
���𰸡� ̼̼˫�� ȩ�� 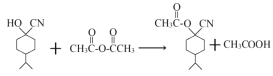 ��ȥ��Ӧ
��ȥ��Ӧ ![]()
![]() ad 14
ad 14 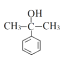
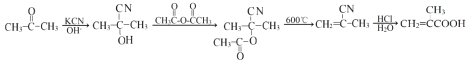
�������������л�����ƶϺͺϳɣ���1�����ݣ�������ˮ��ȩ�Ľṹ��ʽ�����й�������ȩ����̼̼˫������2������G�Ľṹ��ʽ���Ƴ�G�ķ���ʽΪC10H17ON����H�ķ���ʽ��2��̼ԭ�ӡ�2��Hԭ�ӡ�1��Oԭ�ӣ����G����������Ӧ�ķ���ʽΪ ����3������H��I�Ľṹ��ʽ��I������һ��̼̼˫�����Ƴ��˷�Ӧ����Ϊ��ȥ��Ӧ����4��A�ķ���ʽΪC9H12��B�ķ���ʽΪC9H12O3S��
����3������H��I�Ľṹ��ʽ��I������һ��̼̼˫�����Ƴ��˷�Ӧ����Ϊ��ȥ��Ӧ����4��A�ķ���ʽΪC9H12��B�ķ���ʽΪC9H12O3S��
���A����B�ķ�Ӧ����Ϊ�ǻ���Ӧ����B�Ľṹ��ʽΪ![]() ���Ա�I��J�ķ���ʽ���Ƴ�J�Ľṹ��ʽΪ
���Ա�I��J�ķ���ʽ���Ƴ�J�Ľṹ��ʽΪ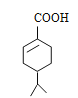 ������J��K�ķ���ʽ��K��Jȱ��1��H��1��O������һ��Cl����J�Ľṹ��ʽΪ
������J��K�ķ���ʽ��K��Jȱ��1��H��1��O������һ��Cl����J�Ľṹ��ʽΪ![]() ����5��J�к����Ȼ���̼̼˫������������ˮ��ȩ�Ľṹ�к���ȩ����̼̼˫����a���Ȼ�����NaHCO3��Һ��Ӧ����CO2����ȩ�����У����Լ��𣬹�a��ȷ��b��������̼̼˫������ʹ��ˮ��ɫ����ˮ���ܼ����������ʣ���b����c��̼̼˫������ʹ���Ը��������Һ��ɫ�����Ը��������Һ���ܼ����������ʣ���c����d��J���Ȼ�������������ͭ�����кͷ�Ӧ����Һ��Ϊ���壬ˮ��ȩ�е�ȩ��������������ͭ����Һ������Cu2Oש��ɫ���������Լ��𣬹�d��ȷ����6������������Ʒ�Ӧ����������˵�������ǻ����ڲ���ʹFeCl3������ɫ��Ӧ��˵���ǻ����뱽��ֱ���������۱�������һ��ȡ��������2��ȡ����������������ͬ���칹����
����5��J�к����Ȼ���̼̼˫������������ˮ��ȩ�Ľṹ�к���ȩ����̼̼˫����a���Ȼ�����NaHCO3��Һ��Ӧ����CO2����ȩ�����У����Լ��𣬹�a��ȷ��b��������̼̼˫������ʹ��ˮ��ɫ����ˮ���ܼ����������ʣ���b����c��̼̼˫������ʹ���Ը��������Һ��ɫ�����Ը��������Һ���ܼ����������ʣ���c����d��J���Ȼ�������������ͭ�����кͷ�Ӧ����Һ��Ϊ���壬ˮ��ȩ�е�ȩ��������������ͭ����Һ������Cu2Oש��ɫ���������Լ��𣬹�d��ȷ����6������������Ʒ�Ӧ����������˵�������ǻ����ڲ���ʹFeCl3������ɫ��Ӧ��˵���ǻ����뱽��ֱ���������۱�������һ��ȡ��������2��ȡ����������������ͬ���칹����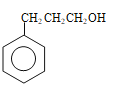 ��
��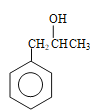 ��
��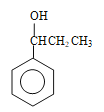 ��
��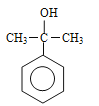 ��
��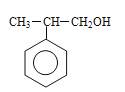 ��
��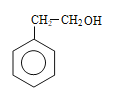 �����ڱ�����������λ�ã���
�����ڱ�����������λ�ã���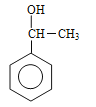 �����ڱ�����������λ�ã���
�����ڱ�����������λ�ã��� ���һ��ڱ�����������λ�ã�������14�֣��˴Ź�������5�ַ壬˵����5�ֲ�ͬ����ԭ�ӣ����˽ṹ��ʽΪ
���һ��ڱ�����������λ�ã�������14�֣��˴Ź�������5�ַ壬˵����5�ֲ�ͬ����ԭ�ӣ����˽ṹ��ʽΪ ����7�����ݺϳ�ˮ��ȩ�ĺϳ�·�ߣ��Ƴ�����
����7�����ݺϳ�ˮ��ȩ�ĺϳ�·�ߣ��Ƴ����� ��·��Ϊ
��·��Ϊ ��
��


 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����
A. ��״���£�2.24LCO�� CO2��������к��е�̼ԭ����ĿΪ0.1NA
B. �ڷDZ�״���£�1mol�κ�����������������22.4L
C. ��״���£�22.4L�ƾ���CH3CH2OH���ķ�����ΪNA
D. ͬ��ͬѹ�£���ͬ�����Ķ�����̼�Ͷ���������������16��11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaBH4������H+��Ӧ������������Ϊ��������о����ȵ㡣������Ϊԭ���Ʊ�NaBH4��һ�ֹ�����������ͼ��ʾ��
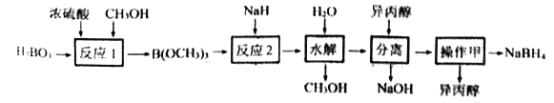
��֪: ��H3BO3���룺H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
�ڷ�Ӧ1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
�۷�Ӧ2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3��____Ԫ�ᣬNaH�ĵ���ʽΪ_______________��
(2)NaBH4��ˮ���ҷ�Ӧ�ų�H2����Ӧ�Ļ�ѧ����ʽΪ________________��
(3)��Ӧ1����______(���л���Ӧ����)����Ӧ����������B(OCH3)3��Ŀ����__________��
(4)��ˮ�⡱ʱ�����Ĵ���NaOH��������NaBH4��ˮ�ķ�Ӧ���ڸò����У���ˮ��Ӧ���ɴ���NaOH��������_________��
(5)�����롱��õ�NaBH4���������Һ����������_____________��
(6)���������п���ѭ��ʹ�õ�������____________��
(7)�Զ��Ե缫���Na[B(OH)4]��NaOH �����ҺҲ���Ƶ�NaBH4�������ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2��O3����Ԫ�ص����ֵ��ʣ����������ʽ������и��⣺
��1����������O2��O3�������Ӹ�����Ϊ___________��ԭ�Ӹ�����Ϊ____________�����ӵ����ʵ���֮��Ϊ__________��
��2�����µ�ѹ�£��������O2��O3�������Ӹ�����Ϊ___________��ԭ�Ӹ�����Ϊ___________��������Ϊ__________��
��3����NAΪ�����ӵ���������ֵ�����a g�����к��еķ�����Ϊb����c g�����ڱ�״���µ����Լ��__________(�ú�NA��ʽ�ӱ�ʾ)��
��4��ʵ����������2mol��L��1��NaOH��Һ950mL������ʱ���ȡ��NaOH��������_____________��
��5���ڱ�״����15gCO��CO2�Ļ�����壬���Ϊ11.2L��������ƽ��Ħ��������__________��CO2��CO�����֮����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������β����Ҫ�ɷ�ΪN2��NO��CO��CO2��SO2�ȣ�ij��ȤС���������ʵ�飬�������β������Ⱦ������ĺ�����
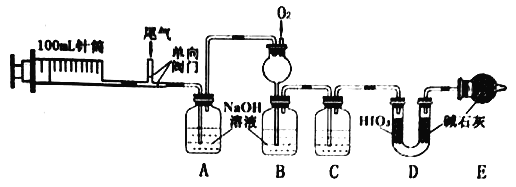
(1)ʵ��ʱ��������N2������������20��(100mL/��)β�����������N2��
�ٵ�һ������N2��������________��
��β�����ö�γ��ͷ�ʽ��Ŀ����________��
(2)C�е��Լ���____________��
(3)װ��D���ڲ���CO��
��HIO3������CO����ԭ����ΪI2����Ӧ�Ļ�ѧ����ʽΪ____________��
��D�м�ʯ�ҵ�������_________��
(4)Ϊ��һ������SO2��������ʵ���A����Һת�Ƶ��ձ������μ��������Լ������ˡ�ϴ�ӡ�����Ƶó���Ϊ1.165g��
�ټ���������Լ�Ϊ_______��(ѡ�����)
a.���� b.˫��ˮ c.BaCl2��Һ d.ϡ����
�ڼ�������Ƿ�ϴ�Ӹɾ��ķ�����_____________��
��β����SO2����Ϊ_____gL-1��
(5)ʵ����B����Һ���Ϊ100mL��NO2-��NO3- ��Ũ�ȷֱ�Ϊ0.0100molL-1��0.0200molL-1��
��B�г���©����������_____________��
��ͨ��O2�����(��״��)����Ϊ___________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)ʮO2(g)![]() 2SO3(g) ��H = -198kJ��mol-1����V2O5����ʱ���÷�Ӧ����Ϊ:
2SO3(g) ��H = -198kJ��mol-1����V2O5����ʱ���÷�Ӧ����Ϊ:
��V2O5+ SO2��2VO2 +SO3(��) ��: 4VO2+O2��2V2O5(��)������˵����ȷ���ǣ� ��
A. ��Ӧ������Ҫȡ���ڢ�Ӧ
B. �÷�Ӧ�淴Ӧ�Ļ�ܴ���198kJ/mol
C. 2molSO2��1molO2��һ�������³�ַ�Ӧ�ܷų�198KJ������
D. �ں��¡����������£��ﵽƽ��������������SO3ƽ�⽫������Ӧ�����ƶ�������SO3������ٷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹���ѧ��Τ��˹̩�أ�����10��ļ��Ŭ����Τ��˹̩���óɶֵ���Ҷ��������ȡ������Ҷ�е��������ʡ���Ҷ���أ�������ΪҶ������ֲ�����������������ã���ʹ��������������档����˵��û�й�����þ�û�����������ͷ�չ�����ڳɹ�����ȡ��Ҷ���أ�1915�꣬Τ��˹̩���ٻ���ŵ������ѧ����Ҷ���صĽṹ��ͼ
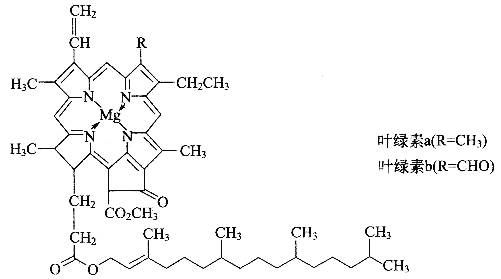
��1��������ò���������������һ��ͬ��������O3���ڸ߿������մ��������ߣ����������ϵ�����Ͷ�ֲ������̲������ߵ��˺�����д��һ�ֶ�����Ԫ���γɵ�O3�ȵ��������________���÷��ӵĿռ乹��Ϊ________������ԭ�ӵ��ӻ�������_________��
��2��þ��Ҷ�����е���Ҫ���Ԫ�أ�þ�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ__________��Ҷ������þ�γɵĻ�ѧ��������___________________��Ҷ���ز�������ˮ���������л��ܼ������Ҵ�����ͪ���������ȷµȣ�����Ϊ______________________________��
��3��Ҷ���ع���Ԫ���У������ڶ�����Ԫ���У���һ�������ɴ�С��˳������Ԫ�ط��ű�ʾ����_______________��������______________________________��
��4��Ҷ���صĹ���Ԫ���У�H��Mg���ڵ�һ�������ڵ�Ԫ�أ����γ�һ�������ʹ�����ϣ�����ṹ��ͼ��ʾ��
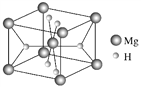
�� �þ���Ļ�ѧʽΪ__________________����֪�þ�����ܶ�Ϊ�� g��cm��3�����������Ϊ________ cm3(�æѡ�NA��ʾ������NA��ʾ�����ӵ�������ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڸ�ͼ��Ľ��ͻ�ó�������ȷ���ǣ�������


A. ͼ�ױ�ʾ0.10molL��1NaOH��Һ�ζ�20.00 mL 0.10 molL��1������Һ�ĵζ�����
B. ͼ�ұ�ʾ��������Һ��ͨ�백����������������Һ������I�ı仯
C. ����ͼ����ʾ��֪��ʯīת��Ϊ���ʯ����������ʯī�Ƚ��ʯ�ȶ�
D. ͼ����ʾ��Ӧ2SO2+O22SO3��t1ʱ��ֻ��С�� SO3��Ũ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com