【答案】
分析:(1)根据信息中硝酸与金属反应时,浓度越稀还原产物价态越低,结合反应过程中无任何气体放出,则金属与混合溶液反应生成铵根离子;
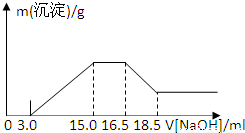
(2)由图可知,从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量;
(3)由图可知,16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,3.0mL到15.0mL区间发生的是金属离子结合生成沉淀,然后利用反应来计算;
(4)由4Mg+10H
++NO
3-═4Mg
2++NH
4++3H
2O、8Al+30H
++3NO
3-=8Al
3++3NH
4++9H
2O及图中开始3.0mLNaOH溶液消耗的酸,计算混合液中硫酸的物质的量的浓度.
解答:解:(1)硝酸根浓度很低时被氧化的产物是铵根离子,因此无气体放出,镁、铝反应生成金属阳离子,则离子反应分别为4Mg+10H
++NO
3-═4Mg
2++NH
4++3H
2O、8Al+30H
++3NO
3-=8Al
3++3NH
4++9H
2O,
故答案为:8Al+30H
++3NO
3-=8Al
3++3NH
4++9H
2O;
(2)由图示可以看出加入氢氧化钠溶液从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,
由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量,
则原溶液中NO
3-物质的量是(16.5-15)×10
-3L×4mol/L=0.006mol,故答案为:0.006mol;
(3)从图示提示中看出从氢氧化溶液体积16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,氢氧化铝与氢氧化钠等物质的量反应,
由Al~Al
3+~Al(OH)
3~NaOH,则Al的物质的量为0.008mol,
再由Mg
2++2OH
-═Mg(OH)
2↓、Al
3++3OH
-═Al(OH)
3↓,
沉淀镁离子和铝离子共消耗氢氧化钠溶液体积(15.0-3.0)mL,
由此可知:沉淀镁离子时消耗的氢氧根离子物质的量为(15.0-3.0)×10
-3L×4.00mol/L-8×10
-3mol×3=24×10
-3mol,镁离子物质的量为1.2×10
-2mol,
参加反应的镁与铝的质量之比:8×10
-3mol×27g/mol:1.2×10
-2mol×24g/mol=3:4,故答案为:3:4;
(4)由4Mg+10H
++NO
3-═4Mg
2++NH
4++3H
2O、8Al+30H
++3NO
3-=8Al
3++3NH
4++9H
2O可知,
消耗氢离子为0.008mol×

+1.2×10
-2mol×

=0.06mol,
图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×10
-3L×4mol/L=0.012mol,
原溶液中硫酸的物质的量为

=0.036mol,
混合液中硫酸的物质的量的浓度为

=0.36mol/L,故答案为:0.36.
点评:本题难度较大,考查金属与酸性条件下硝酸盐溶液的反应,注意硝酸浓度越低生成的还原产物价态越低与反应中无气体生成相结合来分析,并注意图象与化学反应的对应来分析解答.

 +1.2×10-2mol×
+1.2×10-2mol× =0.06mol,
=0.06mol, =0.036mol,
=0.036mol, =0.36mol/L,故答案为:0.36.
=0.36mol/L,故答案为:0.36.
