
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
① 根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:

① 求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1 ~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
(16分,每空2分)
I.(1)硫酸 (或者H2SO4)
(2)a d
(3)① 在常压下,此反应的转化率已经达到96%,没有必要再增大压强了。
② -396.00 kJ/mo1
Ⅱ.(1)① 4.00×10-4
②
(2)① < ② 
【解析】
试题分析:I.(1)二氧化硫的催化氧化是工业生产硫酸的重要步骤;
(2)a、每生成1mol SO3的同时生成0.5mol O2,代表正逆两个反应方向且符合化学方程式中的系数比,符合正逆反应速率相等,达到平衡状态,正确;b、恒容条件下,气体的质量不变,所以气体的密度一直不变,不能判断是否达平衡状态,错误;c、体系中各物质的物质的量之比等于化学计量数之比时不一定达平衡状态,错误;d、该反应的特点是反应前后的气体的物质的量发生改变,所以恒容时气体的压强在变,达平衡时,气体压强不再变化,正确,答案选ac。
(3)①常压下,平衡时二氧化硫的转化率是96%,已经很高,所以没有必要再增大压强了;
②二氧化硫转化96%放出190.08KJ的热量,所以1mol二氧化硫气体完全反应则放出190.08kJ÷96%=198.00kJ的热量,所以该反应的热化学方程式中二氧化硫的系数是2,代表2mol的二氧化硫完全反应,放出的热量是198.00kJ×2=396.00kJ,所以△H=-396.00 kJ/mo1;
II.(1)①根据题意可知氨水的浓度是1mol/L, c(NH4+)= c(OH-)=0.02mol/L,所以氨水的电离常数K= c(NH4+)· c(OH-)/c(NH3·H2O)= 0.022mol/L/1mol/L= 4.00×10-4
②氨水稀释会促进一水合氨的电离,体积变为原来的2倍,则氢氧根离子浓度减小为原来的一半,根据勒夏特列原理,最终氢氧根离子、铵根离子的浓度仍会减小,所以图像的起点在0.01处,最大值在原图像的下方,如图 ;
;
(2)①若a=b,则二者恰好完全反应,溶液呈酸性,现在溶液呈中性,说明氨水过量,所以a<b;
②设二者的体积均是1L,因为b>a,则剩余氨水的物质的量是b-a,体积扩大到原来的2倍,所以剩余氨水浓度:c(NH3·H2O)= 。
。
考点:考查化学平衡状态的判断,转化率的计算,热效应的计算,弱电解质的电离平衡的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015江苏省高二上学期期中化学(必修)试卷(解析版) 题型:选择题
下列说法正确的是
A.摩尔是七个基本物理量之一
B.氮气的摩尔质量是28g
C.0.5mol氢气的体积为11.2L
D.1molH2O约含有6.02×1023个水分子
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省越秀区高一下学期学业水平测试调研化学试卷(解析版) 题型:选择题
下列反应中,不属于取代反应的是( )
A.在催化剂存在条件下苯与溴反应制溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙烯与溴生成1,2二溴乙烷
D.在光照条件下甲烷和氯气反应制氯仿
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省肇庆市第二学期高二期末统测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.糖类、蛋白质都属于天然高分子化合物
B.强紫外线灼伤人体皮肤属于皮肤蛋白质的变性
C.纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体
D.向鸡蛋清溶液中分别加入饱和(NH4)2SO4和CuSO4溶液都能使之聚沉,其原理相同
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.碳酸钠溶液呈碱性,医疗上常用碳酸钠治疗胃酸过多
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:填空题
(16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示:
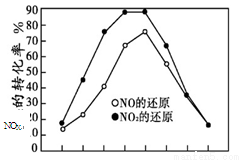
① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
A.加入催化剂 B.降低温度
C.分离出H2O(g) D.增大压强
(3)CO的中毒是由于CO与血液中血红蛋白的血红素
部分反应生成碳氧血红蛋白(Hb·CO),在37℃时:CO+Hb·O2 O2+Hb·CO K=220
O2+Hb·CO K=220
实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也可造成人的智力损伤。抽烟后,测得平衡时人体肺部的空气中CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。请问,抽烟会造成人的智力损伤吗?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
漂白粉的有效成分是
A.Ca(OH)2 B. CaCl2 C. Ca(ClO)2 D.CaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com