
【题目】CO2催化重整CH4的反应:(Ⅰ)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g);ΔH1,
2CO(g)+2H2(g);ΔH1,
主要副反应:(Ⅱ)H2(g)+CO2(g)![]() CO(g)+H2O(g);ΔH2>0,
CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g)![]() CH4(g)+2H2O(g);ΔH3<0。
CH4(g)+2H2O(g);ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )
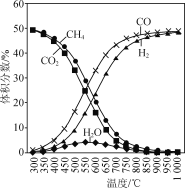
A.ΔH1=2ΔH2-ΔH3<0
B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行
C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量
D.T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81
【答案】BD
【解析】
A. 反应(Ⅰ)可由2倍(Ⅱ)减去反应(Ⅲ)得到,故ΔH1=2ΔH2-ΔH3,再根据图示,随温度的升高,CH4和CO2的体积分数减小,说明升温,平衡正移,而升温平衡向吸热方向移,正反应吸热,ΔH1>0,A不正确;
B. 其他条件不变,适当增大起始时V(CH4)∶V(CO2),即增大CH4浓度和减小CO2浓度,根据平衡移动原理,减小反应物浓度或增加生成物浓度,平衡都逆向移动,B正确;
C. 300~580℃时,H2O的体积分数不断增大,反应(Ⅲ)是放热反应,升温时,平衡逆移消耗H2O,反应(Ⅱ)是吸热反应,升温时正移,生成H2O,而由于反应(Ⅲ)消耗H2O的量小于反应(Ⅱ)生成水的量,C错误;
D. T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则CO2转化的浓度为![]() 根据三段式:
根据三段式:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起 1mol/L 1mol/L 0 0
转0.75mol/L 0.75mol/L 1.5mol/L 1.5mol/L
平 0.25mol/L 0.25mol/L 1.5mol/L 1.5mol/L
若不考虑副反应,则反应(Ⅰ)的平衡常数![]() ,但由于副反应(Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中,分子减小的更多,值小于81,D正确;
,但由于副反应(Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中,分子减小的更多,值小于81,D正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】一定温度下,某密闭恒容的容器内可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态的标志
2C(g)达到平衡状态的标志
A. A的消耗速率是C的分解速率1/2倍
B. 容器内混合气体的密度不随时间而变化
C. 单位时间内生成nmolA,同时生成3nmolB
D. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MgCl2(熔融)![]() Mg(s)
Mg(s)![]() MgO(s)
MgO(s)
B.CaC2(s)![]() C2H4(g)
C2H4(g)![]()
![]()
C.FeS2(s)![]() SO2(g)
SO2(g)![]() (NH4)2SO4(aq)
(NH4)2SO4(aq)
D.Al(OH)3(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() AlCl3(aq)
AlCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO广泛用作消杀剂、水处理剂及漂白剂等。
已知:NaClO溶液中物种分布分数与溶液pH的关系如图1所示。
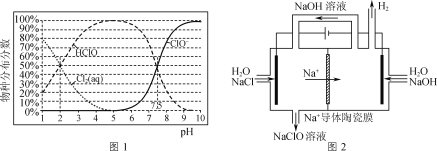
(1)向NaClO溶液中通入CO2,发生反应的离子方程式为___(H2CO3的lgKa1、lgKa2依次为-6.38、-10.21);反应ClO-+H2O![]() HClO+OH-的lgK=____。
HClO+OH-的lgK=____。
(2)用Na+导体陶瓷膜电解法生产次氯酸钠溶液的装置如图2所示。
①阳极产生Cl2的电极反应式为____。
②其他条件不变,若撤去“Na+导体陶瓷膜”,NaClO的产率则会降低,其主要原因是___。
(3)NaClO溶液中ClO-与H2O产生更强氧化性的HClO,可将水体中氨氮氧化为N2(NH3比NH![]() 更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
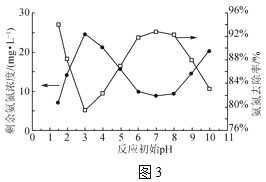
①NaClO氧化NH3的化学方程式为___。
②pH在3~7时,随pH增大氨氮去除率升高的原因是___。
③pH在7~9时,随pH增大氨氮去除率降低的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2O4![]() 2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示。下列说法正确的是
2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示。下列说法正确的是
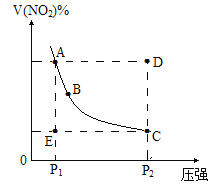
A.A、C两点的正反应速率的关系![]()
B.A、B、C、D、E各状态,![]() 的是状态E
的是状态E
C.维持![]() 不变,
不变,![]() 所需时间为x,维持
所需时间为x,维持![]() 不变,
不变,![]() 所需时间为y,则
所需时间为y,则![]()
D.使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从![]() 突然加压至
突然加压至![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示。有关该化合物的叙述不正确的是( )
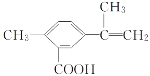
A.该有机物的分子式为C11H12O2
B.1mol该物质最多能与4molH2发生加成反应
C.该有机物在一定条件下,可以发生取代、氧化、酯化反应
D.该有机物与钠反应不如水与钠反应剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com