
| A�� | ��ˮ�е������OH-+H+=H2O | |
| B�� | ʯ������Na2CO3��Һ��Ӧ��Ca2++CO32-=CaCO3�� | |
| C�� | �����ʯ��ˮ��ͨ������������̼��Ca2++2OH-+CO2=CaCO3��+H2O | |
| D�� | ���ˮ����εμ�FeCl3������Һ��Fe3++3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3��+3 H+ |
���� A��һˮ�ϰ�Ϊ������ʣ�������ѧʽ��
B��ʯ��������������Ӧ���ܲ�
C��������̼������Ӧ����̼��ƺ�ˮ��
D�������������岻�dz����������ó������ţ�
��� �⣺A����ˮ�е������ᣬ���ӷ���ʽ��NH3•H2O+H+=H2O+NH4+����A����
B��ʯ������Na2CO3��Һ��Ӧ�����ӷ���ʽ��Ca��OH��2+CO32-=CaCO3��+H2O����B����
C�������ʯ��ˮ��ͨ������������̼�����ӷ���ʽ��Ca2++2OH-+CO2=CaCO3��+H2O����C��ȷ��
D�����ˮ����εμ�FeCl3������Һ�����ӷ���ʽ��Fe3++3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3��+3 H+����D����
��ѡ��C��
���� ���⿼�������ӷ���ʽ����д����ȷ���ʵ����ʼ���Ӧʵ���ǽ���ؼ���ע�⻯ѧʽ�IJ�֣���Ŀ�ѶȲ���


 Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
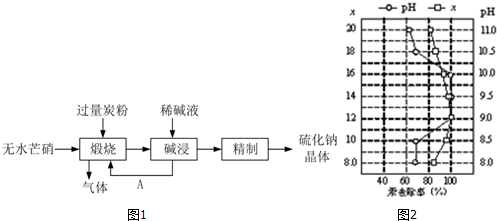
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
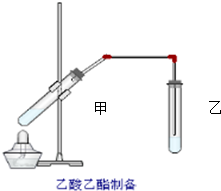 ��ͼ���Թܼ����ȼ���2mL 95%���Ҵ�������ҡ���»�������2mLŨ���ᣬ���ҡ�ȣ���ȴ���ټ���2����ˮ�����ƣ��ò�������ֽ�����Թ̶ܹ�������̨�ϣ����Թ����м���5ml ���͵�̼������Һ����ͼ���Ӻ�װ�ã��þƾ��ƶ��Թܼ�С�����3��5min���ô����ȣ����۲쵽���Թ�������������ʱֹͣʵ�飮�Իش�
��ͼ���Թܼ����ȼ���2mL 95%���Ҵ�������ҡ���»�������2mLŨ���ᣬ���ҡ�ȣ���ȴ���ټ���2����ˮ�����ƣ��ò�������ֽ�����Թ̶ܹ�������̨�ϣ����Թ����м���5ml ���͵�̼������Һ����ͼ���Ӻ�װ�ã��þƾ��ƶ��Թܼ�С�����3��5min���ô����ȣ����۲쵽���Թ�������������ʱֹͣʵ�飮�Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ƿ������ˮϴ���ɲ�������ֱ������������Һ | |
| B�� | ����һ�����ʵ���Ũ�ȵ�ϡ����ʱ������Ͳ��ȡ9.82 mLŨ���� | |
| C�� | ����1 L 0.1 mol•L-1��NaCl��Һʱ��������ƽ����5.85 g NaCl���� | |
| D�� | ����ʱ��Ϊ��ֹҺ�ηɽ�����ͷ�ιܽ�������ƿ�ڱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
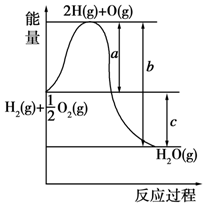 ��֪��H2��g��+$\frac{1}{2}$O2��g���TH2O��g������Ӧ�����������仯��ͼ��ʾ����ش��������⣮
��֪��H2��g��+$\frac{1}{2}$O2��g���TH2O��g������Ӧ�����������仯��ͼ��ʾ����ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
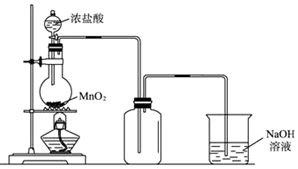
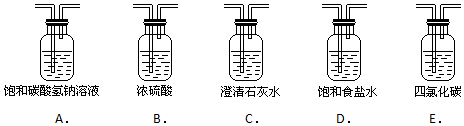
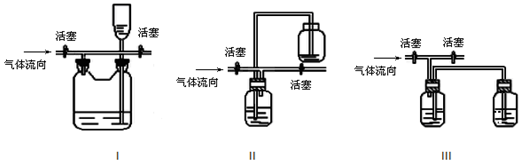
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�16g��������ԭ����Ϊ4NA | |
| B�� | ��״���£�2.24LCH4��NH3����������к��еĵ�����ĿΪNA | |
| C�� | ��״���£�11.2L��HCl����1.0L��ˮ�У�������Һ��HCl��Ũ��Ϊ0.5mol/L | |
| D�� | �����£�5.6���������������ᷴӦ��ʧȥ�ĵ�����Ϊ0.2mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com