
【题目】某课外活动小组学生模拟呼吸面具中的反应原理(过氧化钠与潮湿二氧化碳的反应)。
用如图所示仪器来制取氧气并测量氧气的体积。

上图中的量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~ 50mL),供量气用,乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、稀盐酸、过氧化钠、碳酸钠、大理石、水。
(1)上述装置的连接顺序是(填各接口的編号,其中连接胶管及夹持装置均省略)____________。
(2)C 装置中放入的反应物是_________________________。
(3)装置A的作用是__________,装置B的作用是___________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数并求其差值的过程中,需要注意___________。
A.视线与凹液面最低处平切。
B.待体系恢复至室温再读数。
C.上下移动乙管,使甲、乙两管内液面持平时再读数。
D.反应停止后立即读数。
【答案】 ⑤③④⑥⑦②①⑧(其中⑥⑦顺序可对调) 大理石和稀盐酸 吸收O2中未反应的CO2 吸收CO2中的HCl ABC
【解析】要求利用过氧化钠与二氧化碳(潮湿)反应制取氧气,故首先需要制备二氧化碳,只有仪器C可以用来制取二氧化碳,制气原料应该采用大理石和盐酸,此法制得的二氧化碳中会含有少量氯化氢,须通过装有碳酸氢钠溶液的洗气瓶,以除去氯化氢,然后使净化后的二氧化碳通过过氧化钠来制取氧气,该仪器只能选用装置D,此反应属于气体与固体之间的反应,不易反应完全,为了除去生成的氧气中混有未反应的二氧化碳,可以使它们通过仪器A.在测量氧气体积时,为了使测量更为准确,要注意上下移动仪器E中的乙管,使甲、乙两管的液面相平,以使甲管中的气压与大气气压相等,同时视线应与甲管内凹液面最低处相平,以减少观察误差。
(1)根据上述分析,仪器C可以用来制取二氧化碳,连接③用来除去HCl,④连接⑥可使二氧化碳与过氧化钠反应生成氧气,然后连接②可除去未反应的二氧化碳,最后连接⑧测量气体的体积,所以顺序为⑤③④⑥⑦②①⑧(⑥⑦可颠倒),故答案为:⑤③④⑥⑦②①⑧(⑥⑦可颠倒);
(2)只有仪器C可以用来制取二氧化碳,制气原料应该采用大理石和盐酸,故答案为:大理石和盐酸;
(3)仪器C可以用来制取二氧化碳,制得的二氧化碳中会含有少量氯化氢,须通过装有碳酸氢钠溶液的洗气瓶B,以除去这些氯化氢,净化后的二氧化碳通过过氧化钠来制取氧气,为了除去生成的氧气中混有未反应的二氧化碳,可以使它们通过洗气瓶A,故答案为:吸收氧气中未反应的二氧化碳;吸收二氧化碳中混有的HCl;
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数应注意:①读数时要调节E中甲乙的液面使其同一高度;②读数时视线要与凹液面最低处相平,③反应结束后,不能立即读数,需要待体系恢复至室温再读数,故答案为:ABC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4 , 用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480ml,需用500ml容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A. KOH的碱性比Ca(OH)2的碱性强B. 碘化氢比氟化氢稳定
C. 锂的原子失电子能力比钠弱D. 硫酸的酸性比磷酸的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5 , 实验步骤如下:
Ⅰ.在Na2CO3溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
Ⅱ.加碳酸钠粉末调至pH为7~8;
Ⅲ.再通SO2至pH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体.
(1)制备焦亚硫酸钠总反应的化学方程式为 .
(2)Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 . 步骤Ⅲ中测定溶液的pH的方法是;pH>4.1时,则产品中会有副产物,其化学式是 .
(3)利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, , 重复如上步骤2次,记录数据.(实验中必须使用的试剂有:c1molL﹣1的标准碘溶液、c2molL﹣1的标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)].利用Na2S2O5和FeSO47H2O先后分两个阶段处理含Cr2O72﹣的废水,实验结果见右图.
①实验过程中溶液的pH不断升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31 , lg2≈0.3,c(Cr3+)<1.0×10﹣5 molL﹣1时视为完全沉淀.现将废水中Cr2O72﹣全部转化为Cr(OH)3而除去,需调节溶液的pH范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中,溶质X,Y的浓度都为0.1molL﹣1 , 向混合溶液中滴加某溶液Z(0.1molL﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X,Y,Z分别是( ) 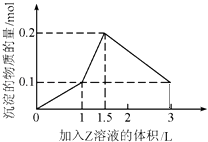
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A. 苹果汁中的Fe2+变成Fe3+
B. 苹果汁中含有Cu2+
C. 苹果汁中含有OH-
D. 苹果汁中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42﹣完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A.3:2:3
B.3:1:2
C.2:6:3
D.1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com