
| A. | 1molH2O的质量是18g/mol | B. | CO2的摩尔质量是44g/mol | ||
| C. | 硫酸的摩尔质量是98g | D. | HCl的相对分子质量是36.5g/mol |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 少量CO2通入漂白液中:CO2+ClO-+H2O═HClO+HCO3- | |
| B. | 向含K+、CO32-、OH-的溶液中通入少量CO2:2OH-+CO2═CO32-+H2O | |
| C. | 强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ | |
| D. | 3molCl2通入含4molFeI2的溶液中充分反应:2I-+Cl2═I2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的元素与被还原的元素质量比为1:1 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | NaBH4即使氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体能发生电泳现象 | B. | 胶体能产生丁达尔现象 | ||
| C. | 胶体粒子直径在1~100nm之间 | D. | 胶体在一定条件下能聚沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
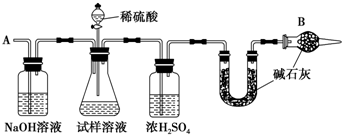
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
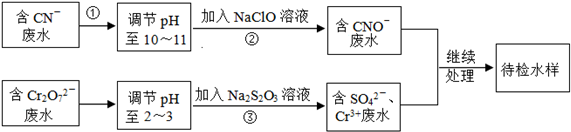
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年1月,国家首次将雾霾天气纳入自然灾情进行通报,雾霾是一种不同于胶体的分散系,它的形成与大量焚烧田间秸秆有关 | |
| B. | 纤维素和淀粉一样可水解成葡萄糖,因此人类可从中获得生存所需的能量 | |
| C. | 2015年诺贝尔化学奖授予从分子水平揭示细胞如何修复损伤DNA以及保护遗传信息的三位科学家,DNA水解产物为氨基酸 | |
| D. | 陶瓷刀号称贵族刀,作为现代高科技的产物,大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
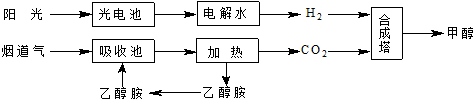
| 反应时间/min | 3 | 5 | 7 | 10 | 13 |
| c(CO2)/mol•L-1 | 0.50 | 0.37 | 0.30 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com