
对已经达到化学平衡状态的下列反应2X(g)+Y2(g)=Z(g),减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
苯亚甲基苯乙酮俗称查尔酮,淡黄色棱状晶体,熔点58 ℃,沸点208 ℃(3.3 kPa),易溶于醚、氯仿和苯,微溶于醇。其制备原理如下:
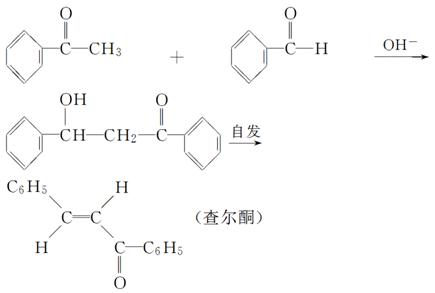
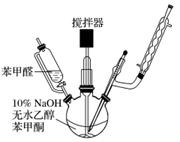
(1)制备过程中,需在搅拌下滴加苯甲醛,并控制滴加速度使反应温度维持在25~30 ℃,说明该反应是________(填“放热”或“吸热”)反应。如温度过高时,则可以采取________措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是
________________________________________________________________________。
(3)结晶完全后,需抽滤收集产物。抽滤装置所包含的仪器除减压系统外还有________、________(填仪器名称)。
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶。加入活性炭的作用是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减少或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积不变的密闭容器中充入1mol NH3,发生反应2NH3 3H2+N2,并达到平衡状态,测得NH3的转化率为x%。若在其他条件不变时,再充入1mol NH3,待建立新的平衡后,测得NH3的转化率为y%,则x和y的正确关系为
3H2+N2,并达到平衡状态,测得NH3的转化率为x%。若在其他条件不变时,再充入1mol NH3,待建立新的平衡后,测得NH3的转化率为y%,则x和y的正确关系为
A.x>y B.x<y C.x=y D.x≥y
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2(g)+H2(g)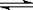 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度T的关系如下表:
| T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
某温度下,在体积为10L的容器中将1.0 mol CO与1.0 mol H2O混合加热,一段时间后达到平衡状态,测得CO的物质的量为0.5 mol。回答下列问题:
(1) 该反应的化学平衡常数表达式为K = 。
该反应的正反应方向ΔH 0(填“<”或“>”)。
(2)上述数据对应的化学平衡状态建立的温度是 。
(3) 若其它条件不变,1000℃时,测得容器中c(CO) = 0. 060 mol·L-1 ,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速率是v正_______v逆(选填大于、小于或等于),其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有热化学方程式:SO2(g)+ 1/2O2(g)==SO3(g) △H =-98.32kJ/mol现有5molSO2参加反应,当放出393.28kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“=”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)多少克锌与500ml 0.1mol/L硫酸恰好反应,在标准状况下能生成多少升氢气?
(2)计算溶质的质量分数为36.5%的浓盐酸(密度为1.19g/cm3)的物质的量浓度是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com