

| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
 (2分)
(2分) CO2或2C+O2
CO2或2C+O2 2CO ,条件用加热或970℃也可)
2CO ,条件用加热或970℃也可) 或
或 (3分,不带单位不扣分,化简也可以)
(3分,不带单位不扣分,化简也可以) ;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。 。
。

 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.SiO2具有较好的导电性,可用于制造半导体材料 |
| B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
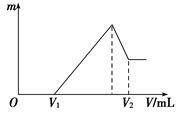
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3 mol·L-1盐酸 |
| B.4 mol·L-1HNO3溶液 |
| C.5 mol·L-1NaOH溶液 |
| D.18.4 mol·L-1H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
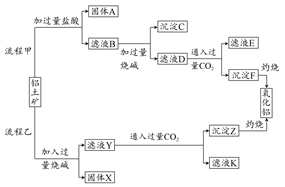
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
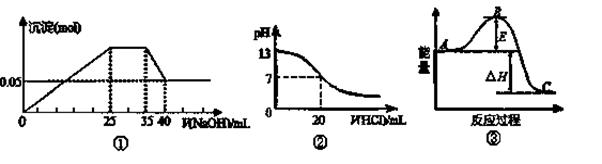
| A.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH 随加入酸体积的变化 |
| B.图①中使用的NaOH的浓度一定为2 mol/L |
| C.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
D.图③中曲线表示3H2(g)+N2(g) 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com