
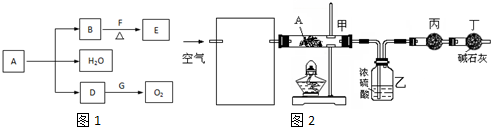
分析 A为绿色固体,含H、C、O、Cu四种元素证明为铜绿.常温下,D为无色无味气体结合与G反应生成氧气判断D为CO2;B为黑色粉末推断为CuO,F和E均为有机物,已知F和E的相对分子质量之差等于2.说明EF反应是在氧化铜催化作用下把醇羟基氧化为醛基;F为醇,E为醛;已知A、B、D、E、F、G为中学化学中常见的化合物,所以判断E为CH3CHO;F为CH3CH2OH,依据判断物质分析回答问题.
解答 解:A为绿色固体,含H、C、O、Cu四种元素证明为铜绿.常温下,D为无色无味气体结合与G反应生成氧气判断D为CO2;B为黑色粉末推断为CuO,F和E均为有机物,已知F和E的相对分子质量之差等于2.说明EF反应是在氧化铜催化作用下把醇羟基氧化为醛基;F为醇,E为醛;已知A、B、D、E、F、G为中学化学中常见的化合物,所以判断E为CH3CHO;F为CH3CH2OH,
(1)D(CO2)跟G(Na2O2)反应的化学方程为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)B(CuO)和F(C2H5OH)在加热条件下反应生成E(CH3CHO)醇去氢氧化反应,反应的化学方程式为:CH3CH2OH+CuO $\stackrel{△}{→}$CH3CHO+H2O+Cu,所以F中一定含有羟基,
故答案为:羟基;
(3)过测定装置甲和乙中试剂的质量变化,探究A的化学式:
①为使数据准确需要把通入的空气中的水蒸气除去,以免影响测定结果,装置为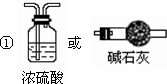 ,
,
故答案为: ;
;
②向装置中鼓入空气的目的是,将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中;丙装置中药品的名称是无水硫酸铜,作用是检查水蒸气是否除净;无变化证明水蒸气除净,A分解产生的水蒸气全部被浓硫酸吸收,
故答案为:将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中;无水硫酸铜;A分解产生的水蒸气全部被浓硫酸吸收;
③判断A已完全分解的方法为,连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g,证明A分解完全,
故答案为;连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g,证明A分解完全;
④实验测得出如下数据:A受热后完全分解,固体由8.0g变为6.0g,装置乙增重0.9g为生成的水的质量,干燥管中增重1.1g为CO2.根据原子守恒,8.0gA中含有的氢元素物质的量为$\frac{0.9g}{18g/mol}$=0.1mol:所含碳元素物质的量为$\frac{1.1g}{44g/mol}$=0.025mol;生成的氧化铜质量为6g;铜物质的量为$\frac{6g}{80g/mol}$=0.075mol;氧元素的质量为8.0g-0.1mol×1g/mol-0.025mol×12g/mol-0.075mol×64g/mol=2.8g,氧元素物质的量为物质的量为=$\frac{2.8g}{16g/mol}$=0.175mol;A中元素原子物质的量之比为n(Cu):n(C):n(H):n(O)=0.075:0.025:0.1:0.175=3:1:4:7;化学式为Cu3H4CO7;结合反应转化可知,结构中含碳酸根,剩余为氢氧根,写出化学式为:Cu3(OH)4CO3或CuCO3•2Cu(OH)2,
故答案为:Cu3(OH)4CO3或CuCO3•2Cu(OH)2.
点评 本题考查了物质转化关系和物质性质的综合应用,实验方案的设计和实验测定的准确操作,化学式的计算判断,实验过程的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
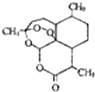 青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )| A. | 易溶于乙醚等有机溶剂 | B. | 分子式为C15H21O5 | ||
| C. | 能在热的NaOH溶液中存在 | D. | 分子结构中含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的物质的量相同 | B. | H+ 物质的量浓度相同 | ||
| C. | OH-的物质的量浓度不同 | D. | H+的物质的量浓度不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com