
| A. | 16O和18O的原子结构示意图均为 | |
| B. | 在Na2O2和CaCl2中均含有共价键和离子键 | |
| C. | 结构示意图为 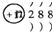 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
分析 A、16O和18O的核内均有8个质子,核外均有8个电子;
B、过氧化钠由离子键和非极性共价键构成;氯化钙中只含离子键;
C、结构示意图为 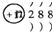 的阴离子可能是Cl-或S2-;
的阴离子可能是Cl-或S2-;
D、氢氧根含10个电子,-OH含9个电子.
解答 解:A、16O和18O的核内均有8个质子,核外均有8个电子,故原子结构示意图均为 ,故A正确;
,故A正确;
B、过氧化钠中钠离子和过氧根之间为离子键,而过氧根中氧原子间为非极性共价键,故过氧化钠由离子键和非极性共价键构成,而氯化钙2个氯离子和钙离子间均为离子键,故B错误;
C、结构示意图为 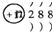 的阴离子可能是Cl-或S2-,若为Cl-,由于不水解,故对水的电离无影响,但若为S2-,是弱酸根,在溶液中水解,对水的电离有促进作用,故C错误;
的阴离子可能是Cl-或S2-,若为Cl-,由于不水解,故对水的电离无影响,但若为S2-,是弱酸根,在溶液中水解,对水的电离有促进作用,故C错误;
在溶液中
D、氢氧根含10个电子,-OH含9个电子,故 只是羟基的电子式,不是氢氧根的电子式,故D错误.
只是羟基的电子式,不是氢氧根的电子式,故D错误.
故选A.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、原子结构示意图、结构式等化学用语的表示方法,明确原子结构示意图与离子结构示意图的区别,试题侧重考查学生的规范答题能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水、液氯都含有氯气分子,均为混合物 | |
| B. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| C. | 胶体与溶液的分散质粒子均可以通过滤纸 | |
| D. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0Ll.0mol.L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 25C时pH=11的Na2C03溶液中水电离出的OH-的数目为0.001NA | |
| D. | 氧原子总数为0.2NA的S02和O2的混合气体,其体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可| A. | 铝合金 | B. | 铜合金 | C. | 碳纤维 | D. | 硅纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刚玉--SiO2 | B. | 明矾--Al2(SO4)3•12H2O | ||
| C. | 小苏打--Na2CO3 | D. | 漂白粉--Ca(ClO)2、CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,下列可以验证C与D两元素原子得电子能力强弱的事实是BCD(填编号).
,下列可以验证C与D两元素原子得电子能力强弱的事实是BCD(填编号).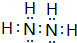 ;C的另一种氢化物与D的一种氢化物的电子总数相等,实验室制取C的该气态氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
;C的另一种氢化物与D的一种氢化物的电子总数相等,实验室制取C的该气态氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去锅炉的水垢:CaCO3+SO42-?CaSO4+CO32- | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 实验室制氯气:KClO3+6H37Cl(浓)═KCl+337Cl2↑+3H2O | |
| D. | HCO3-的水解:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com