
【题目】聚酰胺-66是含有肽键的高分子化合物,常用于生产帐篷、渔网等。可用以下方法合成:
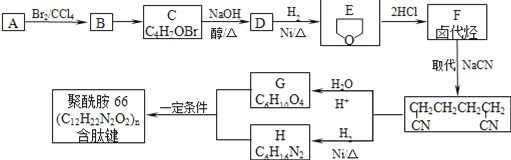
已知:A与E互为同分异构体,完成下列填空:
(1)A→B的反应类型______,A中含氧官能团的名称______
(2)B的结构简式______,D可能的结构简式______
(3)F与氢氧化钠的乙醇溶液共热得到烃I,I的名称______。比I多一个碳原子的同系物,与等物质的量溴反应生成二溴代物的结构简式正确的是______
a.![]()
b.![]()
c.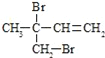
d.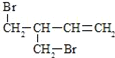
(4)G和H反应生成聚酰胺-66的化学方程式:______
(5)同时满足下列条件的G的同分异构体的结构简式为______
①含一种官能团 ②能发生银镜反应 ③含甲基且有三种化学环境不同的氢原子
【答案】加成反应 羟基 CH2BrCHBrCH2CH2OH ![]() 1,3﹣丁二烯 ac nHOOC(CH2)4COOH+nH2N(CH2)6NH2
1,3﹣丁二烯 ac nHOOC(CH2)4COOH+nH2N(CH2)6NH2![]() HO
HO![]() H+(2n-1)H2O HCOOCH(CH3)CH(CH3)OOCH
H+(2n-1)H2O HCOOCH(CH3)CH(CH3)OOCH
【解析】
由合成流程图可知,A能与溴发生加成反应,说明A中有不饱和键,B再生成C,C的分子式为C4H7OBr,C在NaOH醇溶液中发生消去反应生成D,D分子中有碳碳双键,D和H2加成得到E(![]() )。A与E互为同分异构体,则A的分子式为C4H8O,有一个碳碳双键,结合E的结构可推测,A是直链结构,结构简式为CH2=CHCH2CH2OH,所以B为CH2BrCHBrCH2CH2OH,C为
)。A与E互为同分异构体,则A的分子式为C4H8O,有一个碳碳双键,结合E的结构可推测,A是直链结构,结构简式为CH2=CHCH2CH2OH,所以B为CH2BrCHBrCH2CH2OH,C为![]() ,D为
,D为![]() ,E与2分子HCl反应得F,F与NaCN发生取代反应生成NCCH2CH2CH2CH2CN,F为ClCH2CH2CH2CH2Cl,NCCH2CH2CH2CH2CN水解得G为HOOCCH2CH2CH2CH2COOH,NCCH2CH2CH2CH2CN与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得J聚酰胺-66,据此答题。
,E与2分子HCl反应得F,F与NaCN发生取代反应生成NCCH2CH2CH2CH2CN,F为ClCH2CH2CH2CH2Cl,NCCH2CH2CH2CH2CN水解得G为HOOCCH2CH2CH2CH2COOH,NCCH2CH2CH2CH2CN与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得J聚酰胺-66,据此答题。
(1)根据上面的分析可知,A→B的反应类型为加成反应,A中含氧官能团的名称为羟基;
(2)根据上面的分析可知,B为CH2BrCHBrCH2CH2OH,D为![]() 或
或![]() ;
;
(3)F为ClCH2CH2CH2CH2Cl,F与氢氧化钠的乙醇溶液共热发生消去反应得到烃I为CH2=CHCH=CH2,I的名称为1,3-丁二烯,比I多一个碳原子的同系物为CH2=C(CH3)CH=CH2或CH2=CHCH=CHCH3或CH2=CHCH2CH=CH2,与等物质的量溴反应生成二溴代物为![]() 、
、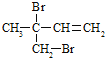 等,故选ac;
等,故选ac;
(4)G和H反应生成聚酰胺66的化学方程式为nHOOC(CH2)4COOH+nH2N(CH2)6NH2![]() HO
HO![]() H+(2n-1)H2O;
H+(2n-1)H2O;
(5)G为HOOCCH2CH2CH2CH2COOH,根据条件①含一种官能团,②能发生银镜反应,说明含有醛基或甲酸某酯,③含甲基且有三种化学环境不同的氢原子,则符合条件的G的同分异构体的结构简式为 HCOOCH(CH3)CH(CH3)OOCH。


科目:高中化学 来源: 题型:
【题目】1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为( )
A. 40 g B. 56 g
C. 60 g D. 64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
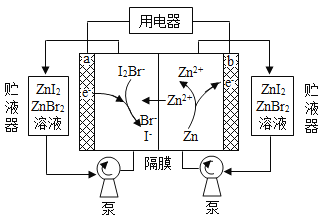
A. 放电时,a电极反应为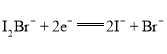
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
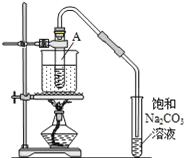
A.试管A中没有发生反应
B.热源小、水量多,水浴升温速度太慢
C.产物蒸汽在试管A上部全部被冷凝回流
D.产物已全部溶解在饱和Na2CO3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.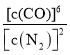 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯(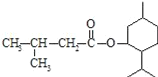 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和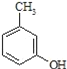 为原料制取。完成下列填空:
为原料制取。完成下列填空:
(1)制取异戊酸薄荷酯的最后一步为酯化反应,其反应物的结构简式为:______
(2) 的名称______,其属于芳香族化合物的同分异构有___种(不含
的名称______,其属于芳香族化合物的同分异构有___种(不含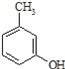 )
)
(3)制取异戊酸薄荷酯的流程中,有一步反应为: +CH3﹣CH=CH2
+CH3﹣CH=CH2![]()
 反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成
反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成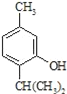 的量远大于生成
的量远大于生成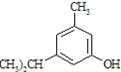 的量,试分析其原因:______
的量,试分析其原因:______
(4)甲基丙烯是重要的化工原料,请设计一条由苯和甲基丙烯通过三步反应制取化工中间体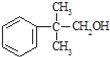 的合成线路______
的合成线路______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制烧碱所用盐水需两次精制。
第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(1)过程Ⅰ除去的离子是_______________。
(2)检测Fe3+是否除尽的方法是____________________。
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因______________。
(4)除去Mg2+的离子方程式是________________。
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____________。
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
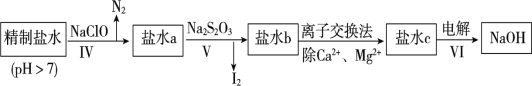
(6)过程Ⅳ除去的离子是__________________。
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是_____。其中一种元素的原子核外s电子数与p电子数相等,写出它的核外电子排布式______。
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。分析用氮化硅制造轴承和发动机中耐热部件的原因是:______。
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)。
a.增加焦炭用量 b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)。
a.c(CO)=3c(N2) b.v(CO)=3v(N2)
c.容器内气体的密度不变 d.气体的压强保持不变
(5)该反应的平衡常数为____,平衡后增加氮气浓度,平衡向______(填“正反应”或“逆反应”)方向移动,K值____(填“变大”“变小”或“不变”)。若测得平衡时气体质量增加了11.2g,则用氮气表示的平均反应速率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com