
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-====Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-====Ni2O3+3H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列与实验相关的叙述正确的是_______________。
A.用石墨电极电解足量NaCl溶液一段时间,要恢复到原溶液,应加入一定量的稀盐酸
B. 可用重结晶法提纯含少量NaCl的KNO3晶体
C.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤
D.测定某溶液的pH时,在湿润的pH试纸上滴加待测溶液,一段时间后,与标准比色卡对比
E.蛋白质溶液中加入硫酸铜溶液,会有沉淀析出,该沉淀不能再溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、
391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
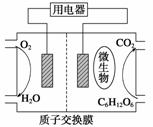
A.该电池能够在高温下工作
B.电池的负极反应式为C6H12O6+6H2O—→6CO2↑+24H++24e-
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体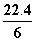 L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
将下图所示实验装置的K闭合,下列判断正确的是( )
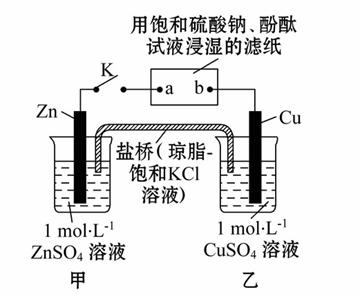
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应2A(g)+B(g) C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是_________。
(2)火箭残骸中常出现红棕色气体,是因为:N2O4(g)  2NO2(g) (Ⅱ)
2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下 列示意图正确且能说明反应达到平衡状态的是__________。
列示意图正确且能说明反应达到平衡状态的是__________。
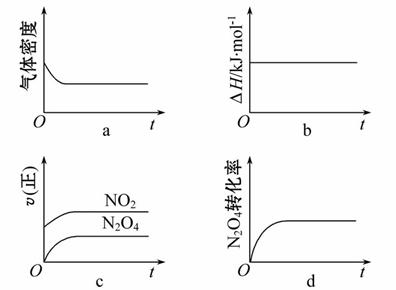
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ______mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①Zn(s)+1/2O2(g)===ZnO(s) ΔH1;②Hg(l)+1/2O2(g)===HgO(s) ΔH2。则反应Zn(s)+HgO(s)===Hg(l)+ZnO(s)的ΔH为( )
A.ΔH1-ΔH2 B.ΔH2-ΔH1
C.ΔH1+ΔH2 D.-(ΔH1+ΔH2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com