
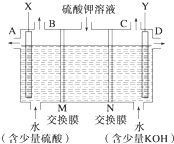
 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.| 11.2L |
| 22.4L/mol |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省张掖二中高三10月月考化学试卷(奥班)(带解析) 题型:填空题
(10分)某课外活动小组同学用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则A极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为_____________,
总反应的离子方程式为_____________ 。
有关上述实验,下列说法正确的是(填序号)________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为______________________。此时通过阴离子交换膜的离子数_______(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省高三10月月考化学试卷(奥班)(解析版) 题型:填空题
(10分)某课外活动小组同学用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为_____________,
总反应的离子方程式为_____________ 。
有关上述实验,下列说法正确的是(填序号)________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
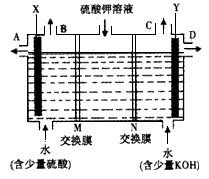
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为______________________。此时通过阴离子交换膜的离子数_______(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com