
【题目】精神病学专家通过实验发现“快乐机理”:在大脑的相应部位—“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如图:
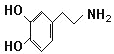
(1)多巴胺分子式:_____。
(2)试判断多巴胺能发生的化学反应_____。
A.加成 B.取代 C.氧化 D.水解
(3)写出所有符合下列条件的与多巴胺互为同分异构体的物质的结构简式____。
①属于1、3、5三取代苯
②苯环上直接连有一个羟基和一个氨基
③分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1
(4)多巴胺可由香兰素与硝基甲烷发生系列反应而得。合成过程表示如图:
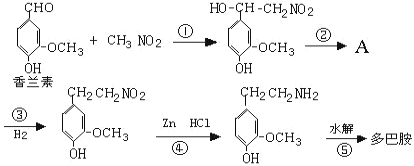
Ⅰ.写出下列反应类型:反应①___,反应④___。
Ⅱ.写出②的化学方程式:___。
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份20mL该溶液进行如下实验:
,现取三份20mL该溶液进行如下实验:
![]() 第一份加入足量盐酸,无任何气体产生
第一份加入足量盐酸,无任何气体产生
![]() 第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
![]() 第三份滴加
第三份滴加![]() 酸性
酸性![]() 溶液,恰好完全反应,消耗其体积为VmL
溶液,恰好完全反应,消耗其体积为VmL
![]() 另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是![]()
A.由实验![]() 、
、![]() 可判定原混合溶液中是否存在
可判定原混合溶液中是否存在![]()
B.由实验![]() 可推断原混合溶液中是否含有
可推断原混合溶液中是否含有![]()
C.由实验![]() 可判定原混合溶液中是否含有
可判定原混合溶液中是否含有![]()
D.原混合溶液中只存在![]() 、
、![]() 、
、![]() ,不可能存在
,不可能存在![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请认真观察图,然后回答问题:
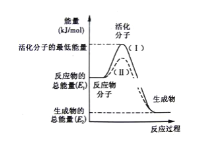
(1)图中所示反应是___(填“吸热”或“放热”)反应
(2)图中所示反应的ΔH=___(用含E1、E2的代数式表示)。
(3)下列4个反应中,符合示意图描述的反应的是____(填代号)。
A.盐酸与NaOH反应 B.Na与H2O反应生成H2
C.铝热反应 D.灼热的炭与水蒸气反应生成CO和H2
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
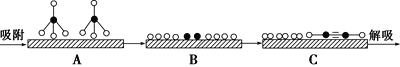
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用![]() 和
和![]() 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
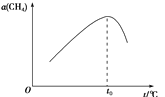
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0 ℃后CH4的转化率突减的原因可能是_______。
(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
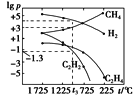
①t1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
②在图中,t3 ℃时,化学反应2CH4(g)![]() C2H2(g)+3H2(g)的压强平衡常数Kp=____。
C2H2(g)+3H2(g)的压强平衡常数Kp=____。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
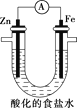
操作 | 现象 |
(i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
(ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
得出结论:①锌______保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用平衡移动原理解释的是( )
A.新制氯水中加入CaCO3固体可增大HClO分子的浓度
B.钢铁在潮湿的空气中比在干燥空气中更容易生锈
C.通入过量的空气与SO2反应可以提高SO2的利用率
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。

下列说法不正确的是( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂![]() 的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
![]()
已知信息如下:
①![]()
②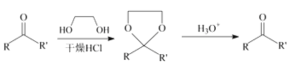
③
(1)A的结构简式为__________________,![]() 的反应类型为_________,C中官能团的名称为________,
的反应类型为_________,C中官能团的名称为________,![]() 的反应方程式为__________________________。
的反应方程式为__________________________。
(2)写出符合下列条件的D的同分异构体_________![]() 填结构简式,不考虑立体异构
填结构简式,不考虑立体异构![]() 。
。
![]() 含有五元环碳环结构;
含有五元环碳环结构;
![]() 能与
能与![]() 溶液反应放出
溶液反应放出![]() 气体;
气体;
![]() 能发生银镜反应。
能发生银镜反应。
(3)已知羟基能与格氏试剂发生反应。写出以![]() 和
和![]() 和格氏试剂为原料制备
和格氏试剂为原料制备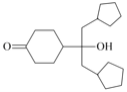 的合成路线
的合成路线![]() 其他试剂任选
其他试剂任选![]() 。_____________
。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com