
【题目】12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A. +2 B. +3 C. +4 D. +5
【答案】B
【解析】
本题没有给出具体的氧化还原反应方程式,不能直接根据化学计量数列比例式计算。但题目给出了氧化剂,还原剂的量,所以只要找到氧化剂和还原剂之间计量关系即可求出还原产物中Cr元素化合价,由此分析。
还原剂与氧化产物、失电子数之间的关系为:Na2SO3~Na2SO4~失2e-;氧化剂与还原产物(设还原产物中Cr的化合价为x)、得电子数之间的关系为:K2Cr2O7~2![]() ~得2(6-x)e-,因为n(Na2SO3)=0.012L×0.1mol/L=0.0012mol,n(K2Cr2O7)=0.02L×0.02mol/L=0.0004mol,根据电子得失守恒列方程式:0.0012mol×2e-=0.0004mol×2(6-x)e-,解得x=3,答案选B。
~得2(6-x)e-,因为n(Na2SO3)=0.012L×0.1mol/L=0.0012mol,n(K2Cr2O7)=0.02L×0.02mol/L=0.0004mol,根据电子得失守恒列方程式:0.0012mol×2e-=0.0004mol×2(6-x)e-,解得x=3,答案选B。


科目:高中化学 来源: 题型:
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是
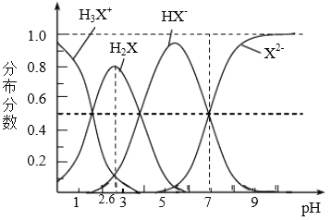
A. 溶液pH由l升至2.6时主要存在的反应是:H3X++OH-=H2X+H20
B. H2X的第二步电离平衡常数Ka2(H2X)为10-4
C. NaHX溶液中c(H+)<c(OH-)
D. 当溶液呈中性时:c(Na+)=2c(X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1 mol L-1 HCl溶液中,Kw=__________________,c(Cl-)=____________,c(OH-)=______________, pH=_______。
(2)25℃时,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈______(填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) ______c(CH3COO-)(填“ >”,“=”或“<” )。
(3)25℃时, pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__________(填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) ______c(CH3COO-) (填“ >” ,“=”或“<” )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的Na2CO3和NaHCO3固体混合物加热至无气体放出为止,称得加热后剩余固体质量比原来减少了6.2 g,现再取同样质量的原固体混合物与过量的盐酸反应,生成15.68 L CO2(标准状况)。请计算:
(1)加热后剩余固体物质的成分是什么_________?
(2)混合物中Na2CO3和NaHCO3的物质的量分别是多少______________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
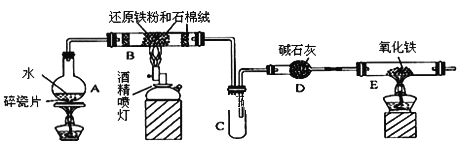
(1)装置B中发生反应的化学方程式是________________________________;
(2)装置E中的现象是______________________________________________。
(3)装置C中右侧导管为什么既不插入试管底部,又不只进入试管一点点,其主要原因是___________.
(4)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①步骤一中通入足量Cl2发生反应的离子方程式为_______________________________________。
②步骤二,从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量Fe2O3和Al2O3的混合固体溶解在200mL 0.1mol·L-1的过量H2SO4溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A. 0.4 mol·L-1 B. 0.2 mol·L-1
C. 0.1 mol·L-1 D. 0.8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1) NH2OH的电子式为________________。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3__________(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为______________________。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:

①该实验适宜的加热方式为______________。
②装置中导管X的作用是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。某工厂设计下列流程图,完成回收硫酸亚铁和铜的简单实验方案。
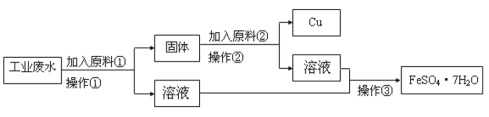
(1)操作①的名称为______,该操作所需要的玻璃仪器为______、_____、烧杯。
(2)原料②的化学式为__________,发生的离子方程式为_________________。
(3)为验证上述流程图中的溶液中含有SO42-:取少量的溶液于试管中,先加入______,再加入________,若观察到有__________,则说明溶液中含有SO42-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com