
在2L的密闭容器中发生化学反应:2NO(g)+2CO(g) N2(g) +2CO2 (g) △H= -746.4kJ/mol。起始反应时NO和CO各为4mol,10秒后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是
N2(g) +2CO2 (g) △H= -746.4kJ/mol。起始反应时NO和CO各为4mol,10秒后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是
A.反应前5秒钟内,用NO表示的平均反应速率为0.1mol/(L·s)
B.达到平衡后,升高温度,可以提高反应物的转化率
C.达到平衡后,反应速率的关系有:υ正(CO) =2υ逆(N2)
D.保持容器体积不变,往容器中充入1molO2,正、逆反应速率都不改变
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:2016届山东省德州市高三上学期期中测试化学试卷(解析版) 题型:填空题
铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为 。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
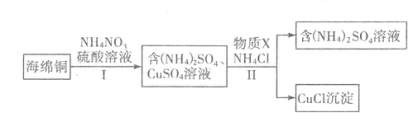
①步骤I中反应温度不宜过高的原因是 ,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为 。
②步骤Ⅱ中物质X可选用 (填字母),该物质需过量的原因,其一是加快反应速率,其二是 。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期11月月考化学试卷(解析版) 题型:选择题
X、Y、Z三种元素的原子,其最外层电子排布分别是ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.X2YZ3 C. X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中模块测试化学试卷(解析版) 题型:选择题
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu20+H2O= 2Cu十2Li++20H-,下列说法不正确的是

A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu20+H2O+2e-=Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu20
D.整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源:2016届四川省巴中市普通高中高三10月诊断性测试理综化学试卷(解析版) 题型:选择题
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH =+140.5kJ?mol-1
C(s,石墨)+ 1/2 O2(g)=CO(g) ΔH =-110.5kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)的ΔH是
A.+80.5kJ?mol-1
B.+30.0kJ?mol-1
C.-30.0kJ?mol-1
D.-80.5kJ?mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.浓盐酸具有强化性能将铜等不活泼金属氧化
B.稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
C.浓硝酸、稀硝酸和浓硫酸都是强氧化剂
D.在室温下,铜既可与浓硝酸反应,也可与浓硫酸反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上11月月考化学试卷(解析版) 题型:选择题
将Na、Na2O、Na2O2的混合物4.34g与足量的水反应,在标准状况下得到672mL混合气体,放电条件下,气体之间恰好完全反应,则它们的物质的量之比为
A、1:1:1 B、1:2:1 C、1:1:2 D、4:3:2
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期期中测试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.Fe2O3溶于过量氢碘酸溶液中: Fe2O3+6H++2I-=2Fe2++I2+3H2O
B.0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体: ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:填空题
某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:
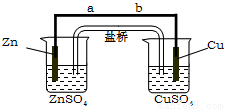
(1)导线中电子流向为__________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为_____;(用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)实验室用惰性电极电解200ml的硝酸银溶液一段时间后,撤去电源,若加入23.2g氧化银恰好使电解液恢复到原来状态,则电解过程中转移电子数为 mol;若加入25.0g氢氧化银恰好使电解液恢复到原来状态,则原硝酸银溶液的物质的量浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com