

 .
.| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
分析 (1)基态碳原子含有6个电子,2个电子排在1S轨道上,2个电子排在2s轨道上,2个电子排在2p轨道上,分占2个轨道,且方向相同;
(2)根据化学式确定其配位数;
(3)与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理书写其基态原子核外电子排布式;
(4)根据晶胞堆积形成较大晶体,按甲虚线方向切乙形成的纵截面分析;
(5)利用均摊法计算确定其化学式,利用沿X、Y、Z三轴切割的方法确定镍原子个数;
(6)Q的电离能较大,且其第一电离能较大,应该为稀有气体元素;
R第一电离能远远小于第二电离能,则R元素原子最外层电子数为1,属于第IA族元素;
S第二电离能远远小于第三电离能,则S元素原子最外层电子数是2,属于第IIA族元素;
T元素第三电离能远远小于第四电离能,则T元素原子最外层电子数是3,属于第IIIA族元素;
U元素第一电离能远远小于第二电离能,则U元素原子最外层电子数是1,属于第IA族元素,据此分析解答.
解答 解:(1)C原子序数为6,则基态碳(C)原子的电子排布图为 ,故答案为:
,故答案为: ;
;
(2)[Cr(H2O)4Cl2]Cl•2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,故答案为:6;
(3)与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理知,其基态原子核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),则其价电子排布式为3d54s1;故答案为:3d54s1;
(4)甲中Fe位于顶点和体心,乙由8个甲组成,按甲虚线方向切乙形成的纵截面边长不相等,则排除B、D,由于每个小晶胞中的体心含有1个Fe原子,则应为A,故答案为:A;
(5)该晶胞中,碳原子个数是1,镁原子个数=8×$\frac{1}{8}$=1,镍原子个数=6×$\frac{1}{2}$=3,所以其化学式为:MgCNi3,利用沿X、Y、Z三轴切割的方法知,晶体中每个镁原子周围距离最近的镍原子有4×3=12,
故答案为:12;MgCNi3;
(6)Q的电离能较大,且其第一电离能较大,应该为稀有气体元素;
R第一电离能远远小于第二电离能,则R元素原子最外层电子数为1,属于第IA族元素;
S第二电离能远远小于第三电离能,则S元素原子最外层电子数是2,属于第IIA族元素;
T元素第三电离能远远小于第四电离能,则T元素原子最外层电子数是3,属于第IIIA族元素;
U元素第一电离能远远小于第二电离能,则U元素原子最外层电子数是1,属于第IA族元素,
①R和U属于第IA族元素,故答案为:R和U;
②T属于第IIIA族元素,则T最可能是P区元素;若T为第二周期元素,T为B元素,E是第三周期元素中原子半径最小的元素,则为Cl元素,T、E形成化合物为BCl3,BCl3中B原子价层电子对个数是3且不含孤电子对,中心原子的杂化方式为sp2,所以其空间构型为平面三角形,故答案为:P;平面三角形;sp2.
点评 本题考查较为综合,题目难度较大,涉及元素电离能、化学式的确定、轨道式的书写、等电子体等知识点,化学式的确定、配位数的确定是常考知识点.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 | |
| D. | 氨气极易溶于水与氨气分子和水分子形成氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
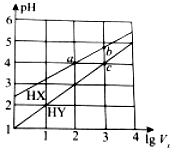 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )| A. | HX为弱酸,HY为强酸 | B. | 当lgV0=7时,HY的pH=8 | ||
| C. | 溶液中水的电离程度:a=c<b | D. | 当lgV0=2时,c(X-)<c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
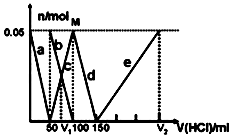 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | V1:V2=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料n | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积/L | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v丙 |
| A. | V甲>V乙 | B. | K丙>K乙 | C. | V甲=V丙 | D. | c乙>c甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
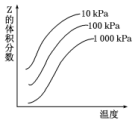 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
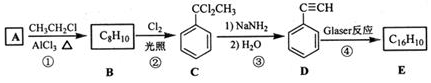
 .
. .
.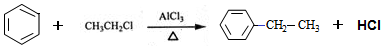 .
. )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为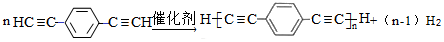 .
.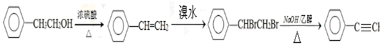 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com