
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
分析 A.容器①与容器②中平衡为完全等效平衡,平衡时相同组分的物质的量相等,故容器②中生成的氨气较少;
B.容器①与容器②中平衡为完全等效平衡,平衡时两个容器中NH3的体积分数相等,根据容器①中放出的热量进行计算解答;
C.平衡常数只受温度影响,温度不变,平衡常数相等;
D.若容器①体积为0.5L,等效为在原平衡的基础上减小压强,平衡逆向移动,反应物转化率减小.
解答 解:A.容器①与容器②中平衡为完全等效平衡,平衡时相同组分的物质的量相等,故容器②中生成的氨气较少,则容器②中达平衡时放出的热量Q<23.15 kJ,故A错误;
B.容器①与容器②中平衡为完全等效平衡,平衡时两个容器中NH3的体积分数相等,容器①中放出热量23.15kJ,则反应的氮气为$\frac{23.15kJ}{92.6kJ/mol}$=0.25mol,
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 2
转化量(mol):0.25 0.75 0.5
平衡量(mol):0.75 2.25 0.5
故平衡时氨气的体积分数为$\frac{0.5mol}{(0.75+2.25+0.5)mol}$=$\frac{1}{7}$,故B正确;
C.平衡常数只受温度影响,容器①与容器②温度相等,增大平衡常数相等,故C正确;
D.若容器①体积为0.5L,等效为在原平衡的基础上减小压强,平衡逆向移动,反应物转化率减小,则则平衡时放出的热量<23.15kJ,故D正确,
故选:A.
点评 本题考查化学平衡计算,侧重考查学生对等效平衡思想运用,关键是理解等效平衡、构建等效平衡建立的途径,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 分子式:C12H10
分子式:C12H10 其苯环上的一氯代物有_5种
其苯环上的一氯代物有_5种 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 1mol该物质消耗5molH2,5molBr21molNa
1mol该物质消耗5molH2,5molBr21molNa查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制备水杨酸对正辛基苯基酯(
制备水杨酸对正辛基苯基酯( )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑ ],温度控制在100℃左右,不断搅拌.
],温度控制在100℃左右,不断搅拌. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
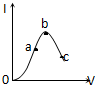 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )| A. | a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c | |
| B. | a、b、c三点处,电离程度最大的是b | |
| C. | a、b、c三点处,c(CH3COO-)最大的是c | |
| D. | 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com