
|
某元素X所形成的气态分子X2共有3种,其相对分子质量依次为70、72、74,此三种分子的物质的量之比是9∶6∶1,则 | |
| [ ] | |
A. |
X有3种同位素 |
B. |
其中一种同位素的原子质量数为36 |
C. |
质量数为35的同位素其原子百分数为75% |
D. |
X2的平均相对分子质量为72 |
科目:高中化学 来源:2014届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出E基态原子的电子排布式 ;E在周期表中的位置是 ,其基态原子有 种能量不同的电子。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,
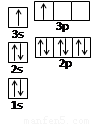
该同学所画的电子排布图违背了 。
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,推测X的晶体类型为 。
(4)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(5) 已知D晶体的粒子堆积方式为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则D晶体的密度为 g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若D的原子半径为r ,则在D晶胞中用r表示出这种堆积模型的空间利用率为 。(列式表示,不需化简)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高一下学期期中考试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
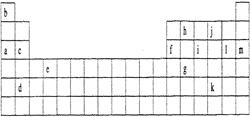
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中的X可能为以上13种元素中的 (用字母序号填写)元素,这种元素和j形成的化合物中若存在共价键,则该化合物的电子式是 ,这种物质属于 (填“离子”或“共价”)化合物。
③Y在周期表中是 族的元素。
④在以上13种元素中, (用字母序号填写)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源:2012届福建省四地六校高二下学期第一次月考化学试卷 题型:填空题
(12分) 图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: _______________________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com