
| A.元素的非金属性:X>Y>Z |
| B.阴离子的还原性:X<Y<Z |
| C.气态氢化物的稳定性:X>Y>Z |
| D.最高价氧化物的水化物的酸性:Z>Y>X |
科目:高中化学 来源:不详 题型:单选题
| A.Tl+的最外层有1个电子 | B.Tl3+的氧化性比Al3+弱 |
| C.Tl 能形成+3价和+1价的化合物 | D.Tl+的还原性比Ag强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

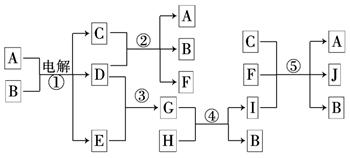
 A+L的化学方程式为: 。
A+L的化学方程式为: 。 。
。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ____.
____. __________________.
__________________. _.
_.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO和O2+ | B.CO和NO | C.NO2和CO2 | D.SO2和ClO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com