
| A. | 升高温度,K值增大 | B. | K值越大,反应物转化率越大 | ||
| C. | 加入催化剂不改变平衡常数K | D. | 平衡向右移动K值不一定改变 |
分析 平衡常数K是温度的函数,只与温度有关,温度一定,平衡常数K值一定,温度发生变化,平衡常数K值也发生变化,以此解答该题.
解答 解:A.在可逆反应中,随着温度的升高,化学平衡向吸热方向移动,所以可能是向正反应方向也可能是向逆反应方向,所以K不一定增大,故A错误;
B.平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,所以K值越大,说明这个反应正向进行的程度越大,故B正确;
C.催化剂不改变平衡移动,则加入催化剂不改变平衡常数K,故C正确;
D.如温度不变,则平衡常数不变,故D正确.
故选A.
点评 本题考查了化学平衡常数表达式和表示意义,为高频考点,侧重考查学生的分析能力,明确化学平衡K的含义是解本题关键,知道K值大小的影响因素,知道所有的平衡常数只与温度有关,与物质的浓度无关,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 平衡膳食就是各种食物都要吃 | |
| B. | 摄入食物中的营养素种类齐全,数量充足,比例适当且与人体的需要的保持平衡才是合理的膳食结构 | |
| C. | 淀粉、油脂、蛋白质为人体提供热能,所以只要这三种摄入量足够就可以了 | |
| D. | 麦芽糖不可以水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
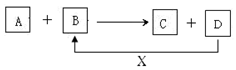 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
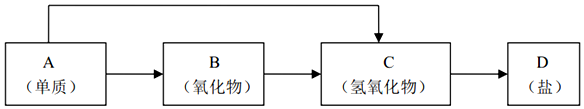
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}S$ | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | H2O2的电子式: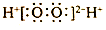 | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释到原体积的10倍,溶液的pH=4 | |
| B. | 加水稀释,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变,n(OH-)增大 | |
| C. | 加入10 mL pH=11的NaOH溶液,所得混合液的pH=7 | |
| D. | 加入少量醋酸钠固体,则平衡CH3COOH?CH3COO-+H+逆向移动,K变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com