
分析 (1)1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.则
CO+H2O(g)?CO2+H2
开始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K;
(2)由①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,
结合盖斯定律可知,$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g);
(3)通入氨气的电极在碱性条件下,失去电子生成氮气和水.
解答 解:(1)1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.则
CO+H2O(g)?CO2+H2
开始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
K=$\frac{0.12×0.12}{0.08×0.18}$=1,
故答案为:1;
(2)由①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,
结合盖斯定律可知,$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),△H=(-574kJ•mol-1+-1160kJ•mol-1)×$\frac{1}{2}$=-867kJ•mol-1,
即热化学方程式为CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1;
(3)通入氨气的电极在碱性条件下,失去电子生成氮气和水,电极反应为2NH3-6e-+6OH-=6H2O+N2,故答案为:2NH3-6e-+6OH-=6H2O+N2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、盖斯定律应用、电极反应为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的综合应用,综合性较强,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,倒置,观察是否漏水 | |
| C. | 在分液漏斗中分离两种液体时,要先从下端放出密度较大的液体,关闭活塞,取另一只烧杯后打开活塞再放出密度较小的液体 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO↑+H2O.
CO↑+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
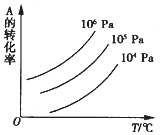 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )| A. | △H<0;△S<0 | B. | △H>0;△S>0 | C. | △H<0;△S>0 | D. | △H>0;△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com