
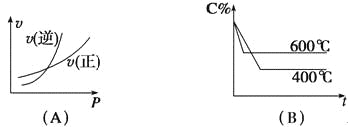
【题目】图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间,图(A)为温度一定时压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
A.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-808.7 kJ/mol
4NO(g)+6H2O(g) △H=-808.7 kJ/mol
B.N2O3(g)![]() NO2(g)+NO(g) △H=+41.8 kJ/mol
NO2(g)+NO(g) △H=+41.8 kJ/mol
C.3NO2(g)+H2O(l)![]() 2HNO3(l)+NO(g) △H=-261.3 kJ/mol
2HNO3(l)+NO(g) △H=-261.3 kJ/mol
D.CO2(g)+C(s)![]() 2CO(g) △H=+171.4kJ/mol
2CO(g) △H=+171.4kJ/mol
【答案】A
【解析】
由图Ⅰ可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图Ⅱ可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应,据此结合选项解答。
A.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,A项正确;
4NO(g)+6H2O(g) △H<0,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,A项正确;
B.N2O3(g) ![]() NO2(g)+NO(g) △H>0,正反应是气体物质的量增大的反应,但正反应是吸热反应,不符合反应特征,B项错误;
NO2(g)+NO(g) △H>0,正反应是气体物质的量增大的反应,但正反应是吸热反应,不符合反应特征,B项错误;
C.3NO2(g)+H2O(l) ![]() 2HNO3(aq)+NO(g) △H<0,正反应是气体的物质的量减小的反应,正反应是放热反应,不符合反应特征,C项错误;
2HNO3(aq)+NO(g) △H<0,正反应是气体的物质的量减小的反应,正反应是放热反应,不符合反应特征,C项错误;
D.CO2(g)+C(s) ![]() 2CO(g) △H>0,正反应是吸热反应,不符合反应特征,D项错误;
2CO(g) △H>0,正反应是吸热反应,不符合反应特征,D项错误;
答案选A。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:![]() +2H2O=NH3·H2O+H3O+
+2H2O=NH3·H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH+2H2O=2![]() +3H2↑
+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基: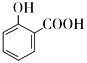 +2
+2![]() →
→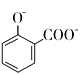 +2H2O+2CO2↑
+2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2![]() +16H++5
+16H++5![]() =2Mn2++10CO2↑+8H2O
=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用手持技术探究氢氧化铝制备实验电导率(电导率越大表示导电能力越强)的变化,浓度均为0.5 mol·L-1 的氢氧化钠和氨水分别滴定0.01 mol·L-1硫酸铝溶液,电导率变化曲线如图所示,下列说法错误的是
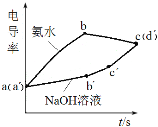
A.a(a)点溶液pH<7
B.bc段电导率下降是因为生成了Al(OH)3沉淀
C.ab段和bc段使用碱的体积比约为3:1
D.b点溶液:c(H+)<2c(SO42-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程:
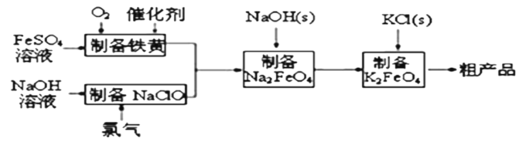
回答下列问题:
(1)已知:常温下,Ksp[Fe(OH)3]=4.0×10—38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_______________molL﹣1
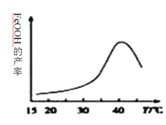
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________。
(3)①高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
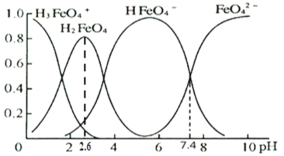
pH=2.6时,溶液中主要含铁形体浓度的大小关系为________。
②已知H3FeO4+电离常数分别为:K1=2.51×10—2,K2=4.16×10—4,K3=5.01×10—8,当pH=4时,溶液中![]() =________。
=________。
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为__________;其中可循环使用的物质____________。
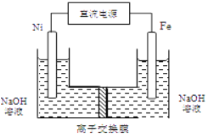
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为
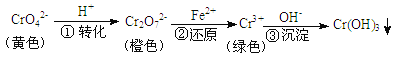
步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)c3(OH-)=10-32,下列有关说法正确的是
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)c3(OH-)=10-32,下列有关说法正确的是
A.步骤①中当v(CrO42-)=2v(Cr2O72-)时,说明反应:2CrO42-+2H+ ![]() Cr2O72- +H2O达到平衡状态
Cr2O72- +H2O达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由黄色变橙色
C.步骤②中,若要还原1 mol Cr2O72- 离子,需要12 mol的Fe2+
D.步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。生成的沉淀过滤除去后,则下列离子组在对应的溶液中一定能大量共存的是
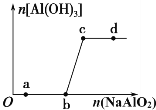
A. a点对应的溶液中:Na+、K+ HCO3- Cl-
B. b点对应的溶液中:Na+、OH-、SO42-、Cl-
C. c点对应的溶液中:Na+、K+、Ag+、NO3-
D. d点对应的溶液中:Na+、K+、OH-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com