
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
分析 根据复分解反应发生的条件及物质的溶解性来分析能够反应且“先产生沉淀,然后沉淀又溶解”,注意反应与量有关.
解答 解:①向饱和碳酸钠溶液中通入过量的CO2,二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和碳酸钠溶液中通入过量二氧化碳后溶液中会产生碳酸氢钠沉淀,但沉淀不溶解,所以符合条件,故选.
②向NaAlO2胶体中逐滴加入过量的稀盐酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后NaAlO2又和稀盐酸反应生成可溶性的氯化铝,所以沉淀又溶解,所以不符合条件,故不选.
③氢氧化钡溶液中缓慢通入二氧化硫至过量,氢氧化钡和二氧化硫反应先生成亚硫酸钡沉淀,后亚硫酸钡和二氧化硫、水继续反应生成可溶性的亚硫酸氢钡,所以看到的现象是“先产生沉淀,然后沉淀又溶解”,所以不符合条件,故不选.
④向硅酸钠溶液中逐滴加入过量的盐酸,硅酸钠和盐酸反应生成难溶性的硅酸,所以看到的现象是“有沉淀生成”,所以符合条件,故选.
故选C.
点评 本题考查物质之间的化学反应,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意有些反应与反应物的量有关,量不同反应现象不同.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| B. | 0.1 L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数是12.5% | |
| B. | 溶液的物质的量浓度是5d/16mol/L | |
| C. | Fe3+的物质的量浓度是5d/8mol/L | |
| D. | 硫酸根离子的物质的量浓度是10d/16mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的相对分子质量之差为168 | |
| B. | B一定不能发生加成反应 | |
| C. | 有机物B与CH3CH2OH互为同系物 | |
| D. | 分子式为C5H10O2且与CH3COOH属于同类物质的有机物只有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度时,HF的Ka增大,水的Kw不变 | |
| B. | 向Mg(OH)2悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大 | |
| C. | 常温下,0.lmol/LNH4Cl 溶液的 pH>7 | |
| D. | 0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
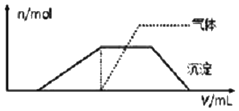 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | Fe3+、H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com