
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
分析 A.碳酸氢根离子不能拆开,应该保留整体形式;
B.硝酸铵为强电解质,在溶液中完全电离出硝酸根离子和铵根离子;
C.硫酸氢钠在溶液中完全电离出钠离子、氢离子和硫酸根离子;
D.氢氧化钡为强电解质,在溶液中完全电离.
解答 解:A.碳酸氢钠在溶液中完全电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开,正确的离子方程式为:NaHCO3=Na++HCO3-,故A错误;
B.硝酸铵在溶液中完全电离,其电离方程式为:NH4NO3=NH4++NO3-,故B正确;
C.硫酸氢钠为强电解质,在溶液中完全电离,其电离方程式为:NaHSO4=Na++H++SO42-,故C正确;
D.氢氧化钡为强电解质,在溶液中完全电离出钡离子和氢氧根离子,其电离方程式为:Ba(OH)2=Ba2++2OH-,故D正确;
故选A.
点评 本题考查了电离方程式的书写判断,题目难度不大,明确电离方程式的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
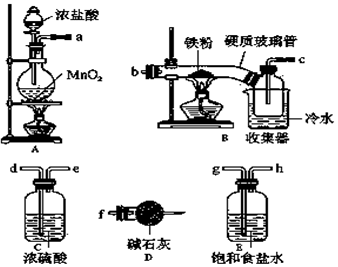
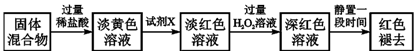
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )
如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )| A. | 该注射液中葡萄糖的质量分数是5% | |
| B. | 葡萄糖的摩尔质量为180g•mol-1 | |
| C. | 该注射液的密度约为1g•mL-1 | |
| D. | 该注射液中葡萄糖的物质的量浓度约为0.014 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
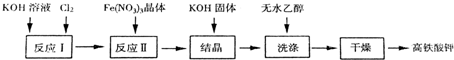
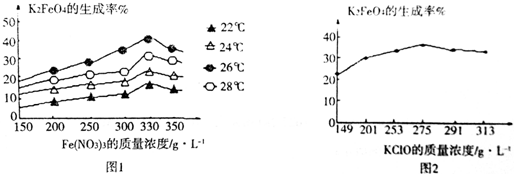
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com