

| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 加热胆矾晶体使其失去结晶水,用图3装置 | |
| C. | 分离CCl4和I2的混合液,如图1和图2操作 | |
| D. | 蒸馏海水得到淡水,用图4装置 |
分析 A.放气的方法:将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
B.应该在坩埚中加热胆矾晶体使其失去结晶水;
C.碘单质易溶于四氯化碳,无法通过分液操作分离;
D.海水中水的沸点较低、盐的沸点较高,可通过蒸馏分离.
解答 解:A.萃取操作时,振荡的过程中需要进行放气,放气的方法:将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,故A错误;
B.图3为蒸发操作,加热胆矾晶体使其失去结晶水需要在坩埚中进行,故B错误;
C.分离CCl4和I2的混合液不分层,无法通过分液分离,故C错误;
D.海水中水的沸点较低,则利用图中蒸馏实验装置可制取少量淡水,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及蒸馏、蒸发、分液等操作,把握物质的性质、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
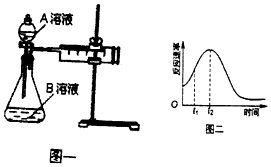
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | $\frac{1}{2}$CO2(g)+H2O(l)═$\frac{1}{2}$CH4(g)+O2(g)△H=+445 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.625 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液 | |
| B. | 500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol | |
| C. | 把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化) | |
| D. | 把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
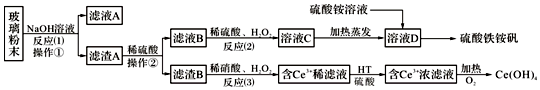
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com