
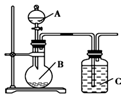
 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
分析 比较S、C、Si的非金属性强弱,可根据对应的最高价氧化物的水化物的酸性强弱比较,以此解答该题.
解答 解:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成同主族元素非金属性强弱比较的实验研究,硫酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,所以A为稀硫酸,B为碳酸钠,C为硅酸钠溶液,硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中,生成硅酸沉淀,
故选C.
点评 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,综合考查学生的分析能力和实验能力,具有较强的综合性,注意实验设计的原理和方法,难度不大.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰升华时须吸收大量的热,这就是化学反应中的吸热现象 | |
| B. | 酒精常被用作酒精灯和内燃机的燃料,说明酒精燃烧是放热反应 | |
| C. | 木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应 | |
| D. | 酸碱中和反应都放热,因此可以将其设计成原电池,将化学能转换成电能供人们使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液淸除铜镜表面的铜锈,是利用了明矾的酸性 | |
| B. | 碘是人体内必须的微量元素,所以富含高碘酸钾的食物适合所有人群 | |
| C. | “光化学烟雾”“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的NH4Cl溶液与(NH4)2SO4溶液相比,前者的c(H+)更小 | |
| B. | 0.1 mol•L-l的CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)>0.1 mol•L-1 | |
| C. | pH=9.4,浓度均为0.l mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将少量AgCl分别加入等体积等物质的量浓度的NaBr溶液与KI溶液中,充分反应后,后者的c(Ag+)更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 物质 | 甲 | 乙 | 丙 |
| A | N2 | O2 | H2 |
| B | Al | 盐酸 | Fe2O3 |
| C | SiO2 | Cl2 | NaOH(aq) |
| D | SO2 | 氨水 | NaHCO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
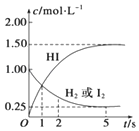 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
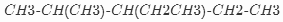 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com