
【题目】某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
回答下列问题:
(1)正确操作步骤的顺序是(用字母序号填写)_________。
(2)排去碱式滴定管中气泡的方法应采用下图操作中的________(填标号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定过程中,眼睛应注视______________。
(4)判断到达滴定终点的实验现象是__________________。
(5)数据记录如下:
滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 20.00 | 0.40 | 20.50 |
第二次 | 20.00 | 4.10 | 24.00 |
第三次 | 20.00 | 1.00 | 24.00 |
根据上述数据,可计算出该盐酸的浓度约为_____________(保留小数点后两位数)。
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有_____(填字母)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管尖嘴部分有气泡,滴定后消失
D.滴定终点读数时俯视读数
E.滴定终点读数时仰视读数
【答案】B、D、C、E、A、F 丙 锥形瓶内溶液颜色的变化 当滴入最后一滴标准液后,溶液由无色变为浅红色,且30s内不褪色 0.10 mol·L-1 AD
【解析】
(1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作。
(2)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡。
(3)滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化;
(4)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点。
(5)第三次测量误差较大,舍去,计算剩余两组消耗NaOH平均值通过化学方程式计算盐酸的浓度;
(6)根据c测=c标V标/V测分析判断。
(1)操作的步骤是选择滴定管,然后洗涤、润洗、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为:B、D、C、E、A、F,故答案为:B、D、C、E、A、F;
(2)碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,故答案为:丙;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点,因此滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化;
(4)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色。
(5)第三次测量误差较大,舍去,剩余两组消耗NaOH溶液的平均值是20mL,由于盐酸溶液的体积也是20mL,所以盐酸的浓度是0.10 mol·L-1。
(6)A. 酸式滴定管使用前,水洗后未用待测盐酸润洗,相当于盐酸被稀释,所测值偏低;
B. 锥形瓶水洗后未干燥,不影响溶液中所含盐酸的物质的量,所以不影响所测值;
C. 碱式滴定管尖嘴部分有气泡,滴定后消失,滴定所需NaOH值偏大,所测盐酸浓度偏大;
D.滴定终点读数时俯视读数,NaOH值偏小,所测盐酸浓度偏小;
E. 滴定终点读数时仰视读数,NaOH值偏大,所测盐酸浓度偏大。
故答案选AD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境中能大量共存的是( )
A.在 =1013的溶液中:NH4+、Ca2+、Cl-、K+
=1013的溶液中:NH4+、Ca2+、Cl-、K+
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、K+
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍![]() 废料中有FeO、
废料中有FeO、![]() 、MgO、
、MgO、![]() 等杂质,用此废料提取
等杂质,用此废料提取![]() 的工艺流程如图1:
的工艺流程如图1:
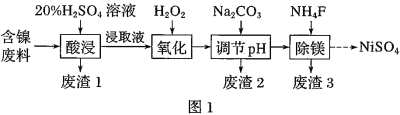
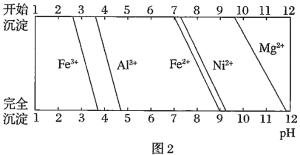
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②![]() 时,
时,![]() 的电离常数
的电离常数![]() 的电离常数
的电离常数![]() ,
,![]()
![]() .
.
(1)加![]() 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______![]() 填化学式
填化学式![]() .
.
(2)![]() 能与饱和
能与饱和![]() 溶液反应产生
溶液反应产生![]() ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释![]() 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答![]() ______.
______.
(3)![]() 时,
时,![]() 的NaF溶液中
的NaF溶液中![]() ______
______![]() 列出计算式即可
列出计算式即可![]() 溶液呈______
溶液呈______![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() .
.
(4)已知沉淀前溶液中![]() ,当除镁率达到
,当除镁率达到![]() 时,溶液中
时,溶液中![]() ______
______![]() .
.
(5)在NaOH溶液中用NaClO与![]() 反应可得
反应可得![]() ,化学方程式为____________;
,化学方程式为____________;![]() 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池![]() 溶液
溶液![]() ,工作原理为:
,工作原理为:![]() ,负极的电极反应式:______.
,负极的电极反应式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释或结论都正确的是![]()
![]()
A.向浓度均为![]() 的
的![]() 、
、![]() 混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明
混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明![]()
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有![]()
C.向![]() 溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
D.某待测溶液可能含有等浓度的下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有
。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有![]() 、
、![]() ,需通过焰色反应确定
,需通过焰色反应确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
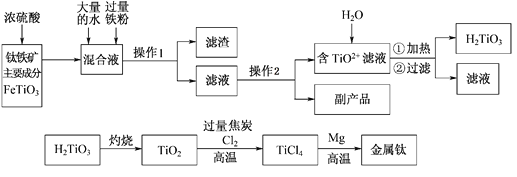
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸是应用广泛的食品防腐剂,其结构如图所示,下列关于山梨酸的说法错误的是( )

A.分子式为C6H8O2
B.1mol该物质最多可与3molH2发生加成反应
C.可使酸性KMnO4溶液褪色
D.可与碳酸氢钠溶液反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2具有独有的脱色能力,适用于印染、造纸行业的污水处理。FeCl3在加热条件下遇水剧烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列问题:
(1)由FeCl3.6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3.6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后再加热,生成FeCl2。
①FeCl3.6H2O中加入SOCl2获得无水FeCl3的化学方程式为__________________。(已知该反应为非氧化还原反应)
②使用NH4SCN可以检验 ii中FeCl3是否含完全转化,请写出离子反应方程式_____________。
(2)利用反应2FeCl3 + C6H5Cl ![]() 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)

①仪器B的名称是_________ ;C的试剂名称是________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经______、_______、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是__________________________。
(3)粗产品中FeCl2的纯度测定。
①取a g粗产品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水至体积为200mL;③用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。若已知消耗酸性高锰酸钾溶液为VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的单位为g·L-1,则k=___________g·L-1·mL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com