
【题目】常稳下,某绝热容器中盛有50mLc(H+)=10-3mol·L-1的HX溶液,向该容器中滴加c(OH-)=10-2mol·L-1的NaOH溶液,滴加过程中混合溶波的温度(T)与所加溶液体积(V)的关系如图所示。下列叙述不正确的是
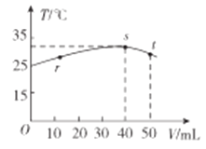
A.s点时:c(Na+)>c(X-)>c(OH-)>c(H+)
B.r→s的过程中,混合溶液中可能存在c(X-)=c(Na+)
C.pH=10的NaX溶液,用蒸馏水稀释10倍后,溶液的pH>9
D.已知某温度下CaX2的Ksp=5.3×10-9mol·L-3,在该温度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高浓度是5.3×10-8mol·L-1
【答案】D
【解析】
由s点温度达到最高,可知s是酸碱完全中和的点。40mL 10-2mol·L-1的NaOH溶液与50mLHX溶液恰好反应,说明HX溶液的浓度是8×10-3mol·L-1,该酸溶液中c(H+)=10-3mol·L-1说明该酸是弱酸。
A、s是酸碱完全中和的点,此时溶质是NaX,NaX为强碱弱酸盐,X-水解,溶液呈碱性,c(Na+)>c(X-)>c(OH-)>c(H+),故A正确;
B、r点溶液呈酸性,s点溶液呈碱性,r→s的过程中溶液可能呈中性,混合溶液呈中性时存在c(X-)=c(Na+),故B正确;
C、 NaX溶液水解呈碱性,稀释促进水解,pH=10的NaX溶液,用蒸馏水稀释10倍后,溶液的pH>9,故C正确;
D. 已知某温度下CaX2的Ksp=![]() 5.3×10-9mol·L-3,在该温度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高浓度是
5.3×10-9mol·L-3,在该温度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高浓度是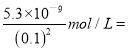 5.3×10-7mol·L-1,故D错误;选D。
5.3×10-7mol·L-1,故D错误;选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
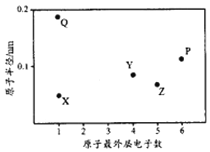
A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C、D 四种元素,它们的原子序数依次增大,由 B、C、D 形成的离子具有相同的电子层结构。C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质,此时 D 转化成具有氖原子核外电子层结构的离子。试填空:
(1)B 元素的名称为_____;D 在元素周期表中位置为_____。
(2)C 原子的结构示意图为_____,A 与 D 形成化合物的电子式为_____。
(3)写出 C、D 单质分别与水反应的化学方程式:C+H2O:_____; D+H2O:_____。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为_____,该物质属于_____(填“离子化合物”或“共价化合物”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.92g甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量。该反应的热化学方程式为__________。
(2)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。
已知:①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1,
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1,
结合上述热化学方程式,计算得出△H1= _______。
(3)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________反应(填“吸热”、“放热”)。
②在反应体系中加入催化剂,化学反应速率增大, E1、E2和ΔH的变化是:E1________,E2_______,ΔH _______(填“增大”、“减小”或“不变”)
③当反应达到平衡时,其他条件不变,升高温度,A的转化率______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取0.lmolL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3B. NH4AC. NH4HSO4D. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3-CH=CH2+HBr![]() CH3-CHBr-CH3主要产物
CH3-CHBr-CH3主要产物![]() 。1mol烃A充分燃烧后可以得到
。1mol烃A充分燃烧后可以得到![]() 和
和![]() 。烃A在不同条件下能发生如下图所示的一系列变化。
。烃A在不同条件下能发生如下图所示的一系列变化。

(1)A的结构简式为______。
(2)上述反应中,①是________反应,⑦是________反应。![]() 填反应类型
填反应类型![]()
(3)写出C、H的结构简式:C______________H____________
(4)写出反应D→F的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
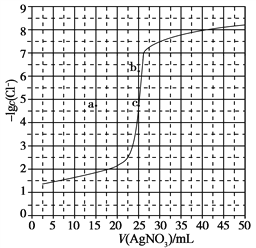
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com